近年来,随着人们对化石能源大量的开发使用,不但使得煤、石油、天然气的储量大大减少,而且直接燃烧化石燃料造成的环境污染问题,也是人类面临的重大挑战,如何实现化石燃料的综合利用,提高效率,减少污染被提上了日程。为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇。某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:
2H2(g)+CO(g)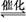 CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
| t/s |
0 |
500 |
1 000 |
| c(H2)/(mol·L-1) |
5.00 |
3.52 |
2.48 |
| c(CO)/(mol·L-1) |
2.50 |
|
|
(1)在500 s内用H2表示的化学反应速率是 。
(2)在1 000 s内用CO表示的化学反应速率是 ,1 000 s时CO的转化率是 。
(3)在500 s时生成的甲醇的浓度是 。
I.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图: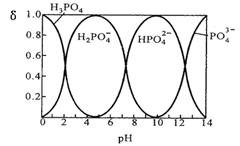
①从图中推断NaH2PO4溶液呈性(填“酸”、“碱”或“中”),这说明。
②在Na3PO4溶液中,c(Na+)/c(PO43—)3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是。
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:
5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O。下图是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率。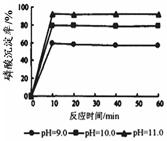
II. 在某温度下,把1.0mol NH3溶于水中配成1L溶液,测得溶液中OH-浓度和时间的图像如下: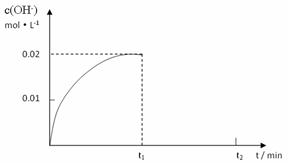
①求该温度时,氨水的电离平衡常数K(写出计算过程,结果保留三位有效数字)
②在t1时刻时再加入H2O配成2L溶液,在t2时刻时重新达到平衡,请在坐标系中画出t1~t2时间内OH-浓度随时间变化的曲线。
③将a mol/L的盐酸和b mol/L氨水等体积混合,所得溶液呈中性(忽略混合前后溶液体积的变化),则混合后溶液中:c(NH3·H2O)=。(用含有a、b的式子表示)
(1)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中, B试管置于冷水中,记录溶液褪色所需的时间。
①需要用来酸化KMnO4溶液,褪色所需时间tAtB(填“>”、“=”或“<”)。
②写出该反应的离子方程式。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入(填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因:;当,证明达到滴定终点。
③计算:重复上述操作2次,记录实验数据如下表。则消耗KMnO4溶液的平均体积为mL,此样品的纯度为。(已知H2C2O4的相对分子质量为90)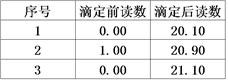
④误差分析:下列操作会导致测定结果偏高的是。
| A.未用标准浓度的酸性KMnO4溶液润洗滴定管 | B.滴定前锥形瓶有少量水 |
| C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 | D.不小心将少量酸性KMnO4溶液滴在锥形瓶外 |
E.观察读数时,滴定前仰视,滴定后俯视
甲醇是一种重要的化工原料。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H= -1275.6 kJ·mol—1
②H2O(l)= H2O(g)△H="+" 44.0 kJ·mol—1
写出表示甲醇燃烧热的热化学方程式。
(2)甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。其反应为:
CH3OH (g)+ H2O (g) CO2(g) +3H2 (g) △H=-72.0kJ/mol
CO2(g) +3H2 (g) △H=-72.0kJ/mol
①该反应的平衡常数表达式为__________________。
②下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
| A.加入催化剂 | B.恒容充入He(g),使体系压强增大 |
| C.将H2(g)从体系中分离 | D.恒容再充入1molH2O(g) |
(3)甲醇可以氧化成甲酸,在常温下用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH) _________ (填“<”或“>”或“=”) 20. 00 mL。
I.已知在25℃时,HF、HCN和H2CO3的的电离平衡常数如表所示:
(1)写出碳酸的第一级电离平衡常数表达式:K1=。
(2)①往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式:
②往NaCN溶液中通入少量CO2,发生反应的离子方程式:
II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是。
海带中含有丰富的碘。为了从海中提取碘,某研究性学习小组设计并进行了以下实验: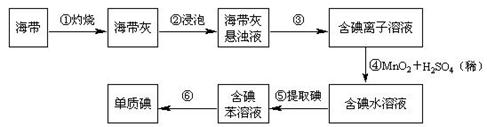
现有下列仪器,请按要求填写以下空白:
(1)其中适用于物质分离的仪器有______________(填名称),使用前需要检验是否漏水的有(填序号)。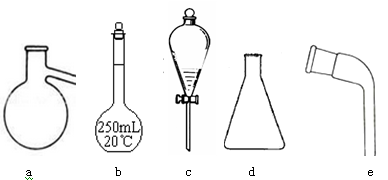
(2)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
(3)步骤③除铁架台、烧杯外,还需用到的仪器有;
(4)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是,上图中还缺少的玻璃仪器是。
(5)步骤⑤中某学生选择用苯来提取碘的理由是。