在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如下图,则下列叙述正确的是 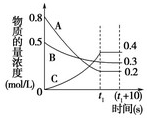
A.该反应的化学方程式为A+3B 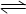 2C
2C
B.在tl s时,v(A)正=0
C.(t1+l0)s时再充入0.4 molA和0.25 mol B,反应物A的转化率增大
D.若该反应在绝热容器中进行,也在tl时刻达到平衡
向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)
| A.0.448 L | B.0.672 L | C.0.896 L | D.0.224 L |
下列相关反应的离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3 +3H+ =Fe3++3H2O |
| B.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3—+Ba2++2OH— = BaCO3↓+2H2O+CO32— |
| C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D.向含有0.4 mol FeBr2的溶液中通入0.1 mol Cl2反应:2Fe2++Cl2=2Fe3+ +2Cl- |
X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性。Z、W、M是第三周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M。下列叙述正确的是
| A.Z是海水中含量最高的金属元素,W是地壳中含量最多的金属元素 |
| B.X、M两元素氢化物的稳定性:X<M |
| C.Z和W的氧化物均可做耐高温材料,M的氧化物可做太阳能电池 |
| D.X、W的最高价氧化物的水化物间反应生成一种可净水的化合物 |
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |