下列化学反应的离子方程式正确的是( )
| A.氢氧化镁中滴加盐酸:H++OH-=H2O |
| B.用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+ |
| C.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
D.NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3-+2OH- NH3+CO32-+2H2O NH3+CO32-+2H2O |
下列事实不能证明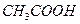 是弱酸的是()
是弱酸的是()
A.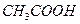 溶液能使石蕊溶液变红 溶液能使石蕊溶液变红 |
B.0.1 mol/L的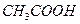 ,H+浓度为0.01mol/L ,H+浓度为0.01mol/L |
C.等物质的量浓度的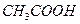 导电能力比盐酸弱 导电能力比盐酸弱 |
D.0.01mol/L的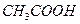 溶液中有两种分子存在 溶液中有两种分子存在 |
向体积相同,pH为1的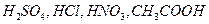 溶液中,分别加入足量的金属镁,下列说法中不正确的是()
溶液中,分别加入足量的金属镁,下列说法中不正确的是()
A.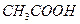 产生的H2最多 产生的H2最多 |
B.HNO3产生的H2最少 |
C.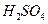 和HCl产生的H2一样多 和HCl产生的H2一样多 |
D.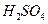 产生的H2比HCl产生的H2多 产生的H2比HCl产生的H2多 |
下列关于强、弱电解质的叙述中,正确的是()
| A.强电解质都是离子化合物,弱电解质都是共价化合物 |
| B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 |
| C.强电解质熔化时都完全电离,弱电解质在水溶液中部分电离 |
| D.强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱 |
 是制备硫酸的重要反应。下列叙述正确的()
是制备硫酸的重要反应。下列叙述正确的()
A.催化剂 不改变该反应的逆反应速率 不改变该反应的逆反应速率 |
| B.增大反应体系的压强,反应速率一定增大 |
C.在 时刻, 时刻, 的分别是 的分别是 ,则时间间隔 ,则时间间隔 内, 内, 生成的平均速率为 生成的平均速率为 |
| D.该反应是放热反应,降低温度将缩短反应达到平衡时间 |
已知

 。有相同容积的定容密闭容器甲和乙,甲中加入 H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中的HI的平衡浓度,应采取的措施是()
。有相同容积的定容密闭容器甲和乙,甲中加入 H2和I2各0.1mol,乙中加入HI0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中的HI的平衡浓度,应采取的措施是()
| A.甲、乙提高相同温度 | B.甲中加入0.1mol He,乙不变 |
| C.甲降低温度,乙不变 | D.甲增加0.1mol H2,乙增加 0.1mol I2 |