为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
(1)请根据甲同学的意图,连接相应的装置,接口的顺序:b接___,___接___,___接a
(2)U形管中所盛试剂的化学式为_________________。
(3)装置③中CCl4的作用是________________。
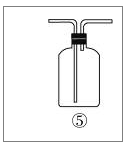
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号)。瓶中可以放入__________________。
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中AgNO3溶液
换成其它溶液。你认为可将溶液换成_____________,如果观察到____________
_________的现象,则证明制Cl2时有HCl挥发出来。
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大.小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌器、量筒、0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,实验尚缺少的玻璃用品是。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是_________。
(3)他们记录的实验数据如下:
| 实 验 用 品 |
溶 液 温 度 |
中和热△H ( kJ·mol-1) |
||||
| t1 |
t2 |
|||||
| 50mL0.55mol·L-1NaOH |
50mL.0.5mol·L-1HCl |
20℃ |
23.3℃ |
|||
| ② |
50mL0.55mol·L-1NaOH |
50mL.0.5mol·L-1HCl |
20℃ |
23.5℃ |
①已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
计算完成上表(结果直接填写在表格中)。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 __(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果 ______(填“有”或“无”)影响。
某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
(1)假设3:。
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是
;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设成立;若出现血红色,则假设成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现
现象,则假设1成立;反之,则假设3成立。
(5)某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论,该结论是否合理?(填“是”或“否”),理由是 。
实验室欲配制0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯②玻璃棒③托盘天平(带砝码)④药匙,按要求填空:
(1)配制时,需称取NaOH的质量是g,还缺少的仪器是
。
(2)使用容量瓶前必须进行的一步操作是。
(3)在配制过程中,其他操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是。(选填序号)
①没有洗涤烧杯和玻璃棒②未等NaOH溶液冷却至室温就转移到容量中
③容量瓶不干燥,含有少量蒸馏水④定容时仰视标线⑤定容时俯视标线
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下:
已知:①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83%~48.0%时易发生爆炸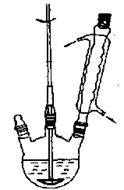

图1制备苯甲酸和苯甲醇的反应装置图图2蒸乙醚的装置图
实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL新蒸过的苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温。反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10 mL水洗涤。
③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2所示蒸馏装置,缓缓加热。升高温度蒸馏,当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分得产品A。将萃取后的水溶液慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤①中所加的苯甲醛为什么要是新蒸的?________________________________。
(2)步骤②萃取时用到的玻璃仪器除了除烧杯、玻璃棒外,还需______________________,饱和亚硫酸氢钠溶液洗涤是为了除去__________________,而碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。
(3)步骤③中无水硫酸镁的作用是_________________,将锥形瓶中溶液转入图2所示蒸馏装置时涉及的实验操作为__________________。
(4)产品A为____________,蒸馏除乙醚的过程中采用的加热方式为_______________,提纯产品B所用到的实验操作为________________。
Ⅰ:选择一种试剂鉴别下列各组物质,将所选试剂的化学式或名称写在横线上:
① 苯、甲苯② 苯、硝基苯、乙醇
③ 苯酚溶液、己烯、己烷、醋酸溶液
Ⅱ:为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计如下甲、乙两方案。
方案甲:
实验1:取少量无水乙醚于试管中,加入少量金属钠。
实验2:各取3mL无水乙醚于试管中,分别加入少量等物质的量的苯酚和乙醇,再投入大小相同的钠块。
方案乙:
各取少量等物质的苯酚和乙醇于试管中,均在60℃的水浴加热,待苯酚熔化后,各放入相同大小的一小块金属钠。(已知:苯酚的密度为1.07g/mL)
(1)方案甲设计实验1的目的是。
(2)方案乙中观察到:在乙醇中,钠很快与乙醇反应产生气体,溶液保持澄清;在苯酚中,钠块表面有少量气泡,且表面产生白色悬浮物,最后白色悬浮物充满苯酚熔融液。
①实验中观察到的白色悬浮物为;
②苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其可能原因有____________、_____________。