下列关于物质的量浓度的表述正确的是 ( )
A.0.3 mol·L-1的Na2SO4溶液中含有Na+和S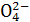 的总物质的量为0.9 mol 的总物质的量为0.9 mol |
| B.1 L水吸收22.4 L氨气时所得氨水的浓度是1 mol·L-1 |
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和S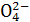 的物质的量相等,则K+和Cl-的物质的量浓度一定相同 的物质的量相等,则K+和Cl-的物质的量浓度一定相同 |
| D.10℃时,100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,再冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1 |
浓度为2mol·L-1的氢溴酸溶液VL,欲使其浓度变为4 mol·L-1,以下列出的方法中,可行的为
| A.通入标况下的HBr气体44.8L |
| B.加入10 mol·L-1氢溴酸0.6VL,再将溶液稀释至2VL |
| C.蒸发掉0.5L水 |
| D.将溶液加热蒸发浓缩至0.5V |
某温度下,在一固定体积的密闭容器中,进行如下化学反应:H2(g)+I2(g) 2HI(g),下列情况能说明该反应一定达到平衡状态的是
2HI(g),下列情况能说明该反应一定达到平衡状态的是
| A.混合气体的颜色不再改变 |
| B.混合气体的压强不再改变 |
| C.单位时间内拆开1mol H-H键,同时生成2mol H-I键 |
| D.混合气体的密度不再改变 |
下列各组离子,在指定环境中一定能大量共存的是
| A.在含有0.1 mol/L Ca2+的溶液中:Na+、K+、ClO-、Cl- |
| B.在pH为7的溶液中:Ag+、Fe3+、SO42-、Cl- |
| C.在澄清透明的无色溶液中:Al3+、Cu2+、HCO3-、NO3- |
D.c(OH-)=1×10 -3mol/L的溶液中:K+、SO42-、Cl-、HCO3- -3mol/L的溶液中:K+、SO42-、Cl-、HCO3- |
下列说法正确的是
| A.pH<7的溶液一定显酸性 |
| B.25℃时,pH=5的溶液与pH=3的溶液相比,前者c(OH-)是后者的100倍 |
| C.室温下,每1×107个水分子中只有一个水分子发生电离 |
| D.在0.1mol/L的氨水中,改变外界条件使c(NH4+)增大,则溶液的pH一定增大 |
关于电解质强弱及非电解质的组合完全正确的是
| A |
B |
C |
D |
|
| 强电解质 |
NaCl |
H2SO4 |
CaCO3 |
HNO3 |
| 弱电解质 |
HF |
BaSO4 |
HClO |
CH3COOH |
| 非电解质 |
Cl2 |
CO2 |
C2H5OH |
H2O |