某天然盐碱湖泊中得到的碳酸钠产品中混有少量氯化钠。用下图所示装置对产品进行碳酸钠的含量分析(已知:CO2在饱和NaHCO3溶液中溶解度很小)。有关实验操作说法正确的是 ( )
| A.锥形瓶中原有的空气对实验结果无影响 |
| B.对取用样品的量的多少无一定要求 |
| C.实验中若改用水,对测定无影响 |
| D.实验中加入盐酸的体积,对测定无影响 |
下列物质既能导电又属电解质的是()
| A.硝酸钾溶液 | B.硫酸铜晶体 |
| C.熔融的氯化钠 | D.无水乙醇 |
0.5mol某不饱和烃跟1molHCl刚好完全反应,生成饱和化合物,该化合物与Cl2在一定条件下发生反应,消耗4molCl2,生成只含碳、氯两种元素的化合物,则该烃是
| A.CH3-CH=CH2 | B.CH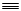 CH CH |
C.CH3-C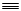 CH CH |
D.CH2=CH-CH=CH2 |
下列说法或表示方法正确的
A.已知C(s)+O2(g)===CO2(g)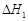 ;C(s)+ ;C(s)+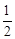 O2(g)= =CO (g) O2(g)= =CO (g)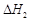 ,则 ,则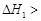 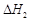 |
B.在稀溶液中,H+(aq)+OH-(aq)===H2O(l); kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热大于57.3 kJ |
C.由C(石墨)===C(金刚石);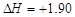 kJ·mol-1可知,金刚石比石墨稳定 kJ·mol-1可知,金刚石比石墨稳定 |
D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2 (g) ===2H2O(l);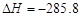 kJ·mol-1 kJ·mol-1 |
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合后,在交换膜处SO42-从右向左移动。下列分析不正确的是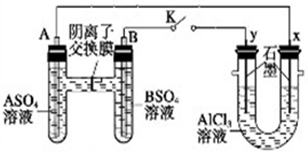
A、溶液中c(A2+)增大
B、B的电极反应:B2++2e-=B
C、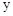 电极上有Cl2产生,发生氧化反应
电极上有Cl2产生,发生氧化反应
D、右边装置反应的离子方程式为:2Cl-+2H2O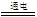 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是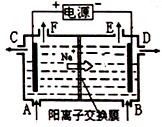
| A.从E口逸出气是H2 |
| B.从B中加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4L Cl2,可同时产生2molNaOH |
| D.若NaCl完全电解后加适量盐酸可以恢复到电解前的浓度 |