某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如下所示。下列说法正确的是 ( )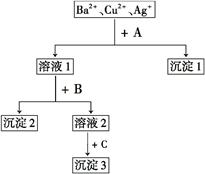
| A.试剂A为盐酸溶液 |
| B.沉淀3的化学式可能是BaSO4 |
| C.生成沉淀1的离子方程式为Cu2++2OH-====Cu(OH)2↓ |
| D.生成沉淀2的离子方程式为Ag++Cl-====AgCl↓ |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是
| A.K+、SiO32-、NO3- | B.NH4+、Al3+、SO42一 |
| C.Na+、OH一、SO42一 | D.Na+、CH3CO一、ClO一 |
在含Na2CO3和NaHCO3各1mol的混合溶液中加入O.5mol下列物质,其中能使HCO3-的数目减少,CO32- 数目增加的是
| A.HCl | B.Na2SO4 | C.NaOH | D.BaCl2 |
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.AlCl3溶液中再溶入AlC l3 l3 |
B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl固体 | D.醋酸溶液加热 |
判断下列有关化学基本概念的依据正确的是
| A.氧化还原反应:是否有电子转移 | B.共价化合物:是否含有共价键 |
| C.强弱电解质:电解质溶解度大小 | D.金属晶体:晶体是否能够导电 |
按纯净物、混合物、电解质和非电解质顺序排列的一组物质是
| A.盐酸、空气、醋酸、干冰 | B.冰醋酸、海水、硫酸钠、乙醇 |
| C.蛋白质、油脂、烧碱、石灰石 | D.胆矾、漂白粉、氯化钾、硫酸钡 |