下列有关镁及其化合物的离子方程式书写正确的是
A.MgCO3与盐酸反应:C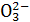 +2H+====CO2↑+H2O +2H+====CO2↑+H2O |
B.Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++S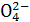 ====MgSO4↓+2H2O ====MgSO4↓+2H2O |
| C.镁与醋酸反应:Mg+2H+====Mg2++H2↑ |
| D.工业上以海水为原料制取Mg(OH)2:Ca(OH)2+Mg2+====Mg(OH)2↓+Ca2+ |
在一定体积的容器中加入1.5mol氙气(Xe)和7.5mol氟气,于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是
| A.1∶2 | B.1∶3 | C.1∶4 | D.1∶6 |
下列实验操作中错误的是
| A.蒸发操作时,应残留少许液体,停止加热,再利用余热使水分完全蒸干 |
| B.蒸馏操作时,应使温度计水银球上端与蒸馏烧瓶的支管口下端相平 |
| C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
在标准状况下,称量一个充满氯气的容器质量为74.6克,若改充氮气,其质量为66克,则容器的容积为
| A.11.2L | B.5.6L | C.4.48L | D.2.24L |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.常温下11.2 L的甲烷气体含有甲烷分子数为0.5NA个 |
| B.14 g乙烯(C2H4)和丙烯(C3H6)的混合物中总原子数为3NA个 |
| C.标准状况下,33.6 L H2O含有9.03×1023个H2O分子 |
| D.5.6 g铁与足量的稀硫酸反应产生氢气的分子数为0.15NA个 |
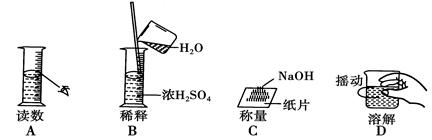
下列四种实验操作,其中有两处错误的是