能正确表示下列反应的离子方程式的是 ( )
| A.向澄清的石灰水中通入SO2气体: Ca2++SO2====CaSO3↓ |
B.过量SO2气体通入氢氧化钠溶液中: SO2+OH-====HS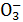 |
C.SO2气体通入溴水中: SO2+Br2+H2O====2H++2Br-+S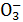 |
| D.氢硫酸中通入氯气: S2-+Cl2====S↓+2Cl- |
(12分)有甲、乙两份等体积的浓度均为0.1 mol/L的氨水,pH为11.
(1)甲用蒸馏水稀释100倍,则NH3·H2O的电离平衡将向______(选填“促进”或“抑制”)电离的方向移动,溶液的pH将为______(选填序号).
| A.9~11之间 | B.11 |
| C.12~13之间 | D.13 |
(2)乙用0.1 mol/L的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH______(选填“甲大”“乙大”或“相等”),其原因是__________________________
________________________________________________________________________.
常温下,向0.1 mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是( )
| A.溶液的pH:a<b<c<d |
| B.溶液的导电能力:a>b>d>c |
| C.a、b溶液呈酸性 |
| D.c、d溶液呈碱性 |
用0.1 mol/L NaOH溶液滴定0.1 mol/L盐酸,如达到滴定终点时不慎多加1滴NaOH溶液(1滴溶液体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( )
| A.4 | B.7.2 |
| C.10 | D.11.3 |
以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10,现用0.1000 mol/L NaOH溶液滴定浓度相近的乙酸时,上述指示剂( )
| A.都可以用 | B.只能用③ |
| C.可以用①或② | D.可以用②或③ |
以酚酞试液为指示剂,对某新制的NaOH溶液进行中和滴定试验,数据记录如下表:
| 待测液 |
消耗标准盐酸 (0.10 mol/L)的体积 |
|
| ① |
20 mL NaOH溶液 |
V1 mL |
| ② |
20 mL NaOH溶液 +10 mL水 |
V2 mL |
| ③ |
敞开隔夜放置的 20 mLNaOH溶液 |
V3 mL |
该新制的NaOH溶液的浓度c mol/L合理的是( )
A.c=0.10×(V1+V2+V3)/(3×20)
B.c=0.10× (V1+V2)/(2×20)
C.c=0.10×(V1+V3)/(2×20)
D.c=0.10V1/20