)氮元素的化合价较多,负价态氮与正价态氮之间发生氧化还原反应时会有氮气产生。下面是甲、乙两位学生提出的两种制备少量氮气的实验方案(箭头表示气体的流向)。
甲:空气→碱石灰→红磷(点燃)→水→铜粉(灼热)→集气瓶
乙:NH4NO2(加热)→浓硫酸→镁粉(灼热)→集气瓶(提示:NH4NO2 N2↑+2H2O)
N2↑+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制氮气?
甲 、乙 (填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此小题不用回答) 。
(3)甲方案中碱石灰和乙方案中浓硫酸可否交换位置?说明理由:
。
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:。
(2)装置②中产生ClO2的化学方程式为 。
装置④中发生反应的离子方程式为。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;②;③;④低于60oC干燥,得到成品。
(4)目前已开发出用电解法制取ClO2的新工艺。
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为。
2014年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为2NO(g)+2CO(g) 2 CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2 CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
(1)该反应的△H0(选填“>’’、“<")。
(2)在T2温度下,0~2 s内的平均反应速率v(N2)=
(3)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填代号)。
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
| 化合物 |
X |
Y |
Z |
| 分子中含有的原子个数 |
/ |
4 |
/ |
| 摩尔质量/g·mol-l |
32 |
34 |
/ |
回答下列问题:
(1)X常用作火箭推进剂,其分子的球棍模型为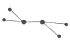 ,则X的化学式为 .
,则X的化学式为 .
(2)Y的化学性质描述正确的是。
a.不稳定性 b.弱碱性 c.氧化性 d.还原性
(3)Z的化学式可用H2A表示。将一定量的Z气体通入0.05mol·L-1CuSO4溶液中,二者恰好完全反应。已知Ksp(CuA)=6.0×10-36。若不考虑溶液体积的变化,则:
①反应后溶液的pH=。
②若反应后溶液中c(A2-)=2.0×10-30mol·L-1,则溶液中c(Cu2+)=mol·L-1。
(4)将一定量的Z气体通人NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。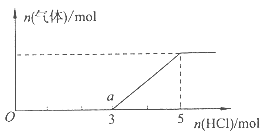
①O点溶液中所含溶质的化学式为。
②已知a点溶液呈碱性,该溶液中离子的物质的量浓度由大到小的顺序是。
(1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是。
②乙同学取10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b应满足的关系是(用等式或不等式表示)。
③丙同学取出10 mL 0.10mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是,则证明—水合氨是弱电解质。
(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是。
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
(3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,则一水合氨的电离常数Kb=。
A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。回答以下问题: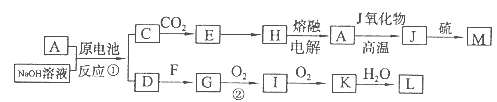
(1)A的原子结构示意图为,M的化学式为。
(2)A与NaOH溶液反应的离子方程式为。
(3)写出②的化学方程式。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。X的水溶液与NaHCO3溶液混合,反应的离子方程式为。