对汽车尾气的处理有人提出下列做法:在马路上铺设“光触媒”(如二氧化钛)物质,将空气中的氮氧化物、一氧化碳、二氧化硫等污染物在催化剂表面转化、分解成对人体、环境基本无害的物质。下列有关说法正确的是 ( )
| A.此法可将汽车尾气中的CO在催化剂表面氧化生成CO2 |
| B.此法可将汽车尾气中的NOx在催化剂表面氧化生成N2 |
| C.此法可将汽车尾气中的二氧化硫还原成三氧化硫 |
| D.此法是解决城市空气污染的唯一途径 |
面对日益恶化的地球生态环境,联合国环境规划署建议“低碳生活方式”降低二氧化碳等温室气体的排放,人人行动来保护我们生存的家园.下列说法正确的是( )
A.CO2的比例模型为 |
| B.用过氧化钠吸收CO2是目前比较经济的减碳方案 |
| C.16O=C=18O与16O=C=16O互为同位素且化学性质相似 |
| D.从我做起节电、节气等低碳生活方式可减少温室气体排放量 |
下列有关物质性质的比较中,正确的是( )
①热稳定性:CH4>NH3>H2O ②还原性:I->Br->Cl- ③酸性:H3PO4>H2SO4>HClO4 ④原子半径:Na>Mg>O
| A.①③ | B.②④ | C.①④ | D.②③ |
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是 ( )
| A.b、a、d、c、e | B.e、b、a、d、c | C.b、a、e、d、c | D.c、d、e、a、b |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是 ( )
A.CO2的电子式 |
B.Cl-的结构示意图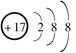 |
| C.乙烯的结构简式C2H4 |
D.NH4Cl的电子式为: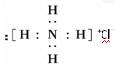 |
环境问题已成为人类社会面临的重大威胁,各种污染数不胜数.下列名词与环境问题无关的是 ①温室效应 ②赤潮 ③酸雨 ④光化学污染 ⑤臭氧空洞 ⑥水俣病 ⑦潮汐 ⑧大脖子病()
| A.①② | B.⑦⑧ | C.⑥⑦⑧ | D.②⑤⑦ |