已知H+(aq) + OH-(aq) = H2O (l) ;△H =" -57.3" KJ/mol . 则下列热化学方程式正确的是
| A.CH3COOH(aq) + NaOH(aq) = CH3COONa (aq) + H2O(l); △H=-57.3KJ/mol |
| B.H2SO4(aq) + Ba(OH)2(aq) = BaSO4 (s) + 2 H2O(l) ; △H= -114.6KJ/mol |
| C.HCl(aq) + NaOH(s) =" NaCl" (aq) +H2O(l) ; △H= -57.3KJ/mol |
| D.HI(aq) + KOH(aq) =" KI(aq)" + H2O(l) ;△H= -57.3KJ/mol |
将等体积的苯、乙苯和水在试管中充分混合后静置。下列图示现象正确的是
下列化学式表示的一定是纯净物的是
A.C3H8 B.C12H22O11
C.C2H4O2
下列物质属于同系物的是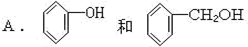
B.CH3CH2Cl和CH2ClCH2CH2Cl
C.C2H5OH和CH4O
D.CH3COOH和C17H33COOH
化学已深入我们的生活,下列说法不正确的是
| A.醋酸可除水垢 |
| B.甘油可做护肤保湿剂 |
| C.包装用的聚氯乙烯属于烃 |
| D.酯类物质是形成水果香味的主要成分 |
已知烯烃经臭氧氧化后,在Zn存在下水解,可得醛或酮。如: ,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物。符合该条件的结构共有
,现有化学式为C10H20的烯烃,它经臭氧氧化后在Zn存在下水解只生成一种有机物。符合该条件的结构共有
| A.7种 | B.6种 | C.5种 | D.4种 |