下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题: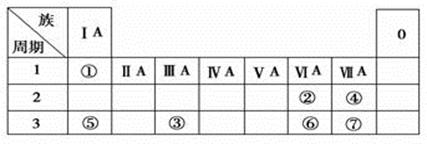
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用化学用语表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。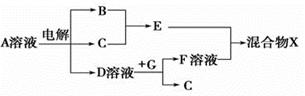
①写出D溶液与G反应的化学方程式: 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液中的c(OH - ) =10-2 mol/L (忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
25℃、101 kPa下,碳、氢气、乙烯和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、1411.0kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
| A.C(s)+O2(g)=CO(g)△H=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g)△H=+571.6 kJ/mol |
| C.C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-1411.0 kJ/mol |
| D.1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1 400 kJ/mol |
在一定温度下,硫酸铜晶体的培养皿中存在下列平衡: Cu2++SO42-+x H2O  CuSO4·xH2O,当向硫酸铜溶液(析有硫酸铜晶体)中加少量无水硫酸铜粉末后,下列说法中正确的是()
CuSO4·xH2O,当向硫酸铜溶液(析有硫酸铜晶体)中加少量无水硫酸铜粉末后,下列说法中正确的是()
| A.溶液中Cu2+浓度增大 | B.溶液中Cu2+数目不变 |
| C.硫酸铜晶体体积增大 | D.溶液的蓝色变浅 |
反应3H2(g) + N2(g)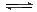 2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是()
2NH3(g) ΔH = -46.19 kJ. mol—1,关于这个反应的平衡常数K,下列说法正确的是()
| A.随温度升高K增加 | B.随压强升高K增加 |
| C.随温度升高K减小 | D.随压强升高K减小 |
对于气体反应mA(g)+nB(g)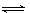 pC(g)+qD(g)△H的下列4个图象中,图象及对应解读均正确的是()
pC(g)+qD(g)△H的下列4个图象中,图象及对应解读均正确的是()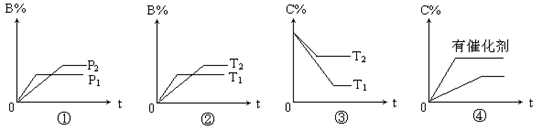
| A.图①表示反应从正反应开始,m+n>p+q |
| B.图②表示反应从逆反应开始,△H>0 |
| C.图③表示反应从逆反应开始,△H>0 |
| D.图④表示反应从正反应开始,有无催化剂参与反应的比较 |
反应FeO(s)+C(s)=Fe(s)+CO(g);△H>0,ΔS>0,下列说法正确的是()
A.低温下自发进行,高温下非自发进行 B 高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D任何温度下均为自发进行