为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是
| A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 |
| B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量硫酸亚铁铵晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中含有NH4+ |
用下列实验装置进行相应实验,能达到实验目的的是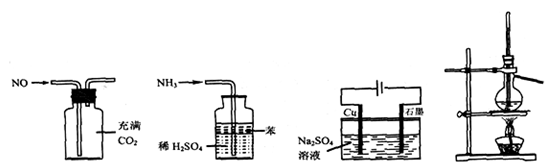
图1图2图3图4
| A.用图1所示装置(正放)可收集NO气体 |
| B.用图2所示装置可吸收多余氨气且能防止倒吸 |
C.用图3所示装置可实现反应:Cu+2H2O Cu(OH)2+H2↑ Cu(OH)2+H2↑ |
| D.用图4所示装置可分离乙醇(沸点78.4℃)与二甲醚(沸点24.9℃)的混合物 |
下列有关物质性质或应用的说法正确的是
| A.制水泥和玻璃都用石灰石作原料 |
| B.利用Al2O3制作的坩埚,可用于熔融烧碱 |
| C.Si可用作太阳能电池和光导纤维的材料 |
| D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
下列关于反应过程中能量变化的说法正确的是
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
常温下,下列溶液中各组离子一定能够大量共存的是
| A.加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
| B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
C.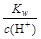 =0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3— =0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3— |
| D.通入足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO- |
下列有关化学用语表示正确的是
A.Cl-的结构示意图: |
B.次氯酸的结构式: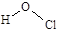 |
C.CH3F的电子式: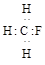 |
D.CO2的分子比例模型: |