今有一混合物的水溶液,可能大量含有以下离子中的若干种:K+、NH4+、Cl—、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下针对原溶液的推测正确的是
| A.Cl—一定不存在 | B.K+一定存在 | C.Mg2+一定存在 | D.Ba2+可能存在 |
下列有关电解质溶液说法正确的是
| A.向冰醋酸中逐滴加水稀释的过程中,溶液导电能力一直减小 |
| B.等浓度的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] |
| C.等体积等浓度的CH3COONa、NaClO溶液中,前者离子总数小于后者 |
| D.等浓度的三种溶液中:①NH4HCO3、②NH4Cl、③NH4HSO4,c(NH4+)的大小顺序为:③>②>① |
现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,一定条件下存在反应:H2(g) + I2(g) 2HI(g) ΔH<0,恒容条件下在Ⅰ中充入1 mol H2和1 mol I2(g),恒压条件下在Ⅱ中充入2 mol HI(g),绝热条件下在Ⅲ中充入2 mol HI(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g) ΔH<0,恒容条件下在Ⅰ中充入1 mol H2和1 mol I2(g),恒压条件下在Ⅱ中充入2 mol HI(g),绝热条件下在Ⅲ中充入2 mol HI(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅱ中达平衡所需时间相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.平衡时容器Ⅱ中c(I2)小于容器Ⅲ中的c(I2) |
| D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
用下列实验装置进行相应实验,能达到实验目的的是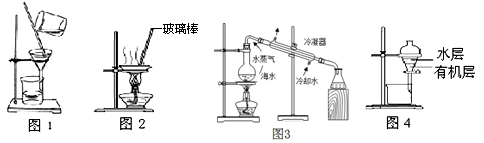
| A.用图1 所示装置除去鸡蛋清中含有的少量实验杂质 |
| B.用图2 所示装置蒸干MgCl2饱和溶液制备无水MgCl2晶体 |
| C.用图3 所示装置从海水制取蒸馏水 |
| D.用图4 所示装置分离酒精萃取碘水中的碘 |
向含等浓度FeCl3、Al2(SO4)3的混和液中逐滴加入Ba(OH)2溶液,形成沉淀的情况如下图所示。沉淀的生成与溶解的pH列于下表。以下推断错误的是
| A.OA段可能发生的反应有:2Fe3++6OH-+3Ba2++3SO42-=3BaSO4↓+2Fe(OH)3↓ |
| B.AB段溶液中加入KSCN溶液显血红色 |
| C.C点的沉淀为:Fe(OH)3和 BaSO4 |
| D.C点后的溶液中:K+、Na+、NO3-、Cl-能大量共存 |
用NA表示阿伏加德罗常数,下列说法中正确的是
| A.23g Na完全转化生成Na2O和Na2O2,失去电子数为NA到2NA之间 |
| B.常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA |
| C.含2mol H2SO4的浓硫酸与足量铜微热反应,生成SO2分子数为NA |
| D.粗铜精炼时转移1mol电子,阳极上溶解的Cu原子数一定为0.5 NA |