已知A、B、C、D均是气体,反应A+B  C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是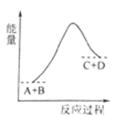
A.当A的正反应速率与C的逆反应速率相同时处于平衡状态
B.当A、B、C、D的浓度相同时,反应处于平衡状态
C.反应物的总键能量低于生成物的总键能
D.该反应是放热反应
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是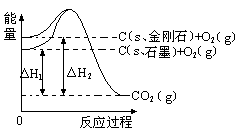
| A.石墨和金刚石的转化是物理变化 |
| B.C(s、石墨)==C(s、金刚石) △H=" +1.9" kJ•mol-1 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
化学反应的发生一般可通过现象加以判断。根据下列现象判断,其中没有新物质生成的是
①蛋白质溶液中加入硫酸铵后形成沉淀
②向氢氧化铁胶体中滴加盐酸产生沉淀;
③二氧化氮经加压冷凝成无色液体;
④溴水滴入裂化汽油中振荡褪色;
⑤硫酸铜粉末滴加少量水变蓝;
⑥活性炭除去水中的颜色和异味
| A.①②③ | B.②④⑥ | C.④⑤⑥ | D.①②⑥ |
.生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是
| A.“加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质 |
| B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 |
| C.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质 |
| D.“酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 |
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
下列表述正确的是(NA代表阿伏伽德罗常数的数值)
| A.1molCO燃烧时放出的热量为283 kJ/mol |
| B.Na2O2(s)+CO(g)=Na2CO3(s)ΔH=-509 kJ/mol |
| C.Na2O2(s)与CO2(g)反应放出226 kJ热量时电子转移数为2NA |
| D.Na2O2和Na2CO3中阴阳离子个数比不同 |
下列表述正确的是
| A.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3-可共存 |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2 CO(g)+O2(g)反应的△H=+566.0kJ/mol |
| C.将SO2通入Ca(ClO)2溶液中: Ca2++ 2ClO-+ SO2 + H2O=CaSO3↓ + 2 HClO |
| D.在某钠盐溶液中含有等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中的一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但仍澄清,阴离子种数减少3种,则原溶液中一定有CO32- |