NA为阿伏伽德罗常数,下列叙述错误的是
| A.标准状况下,11.2 L氦气中含有0.5 NA原子 |
| B.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0. 2 NA |
| C.常温常压下,46g NO2和N2O4混合气体中含有原子总数为3NA |
| D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
下列对于“摩尔”的理解正确的是
| A.摩尔是国际科学界建议采用的一种物理量 |
| B.摩尔是物质的量的单位,简称摩,符号为mol |
| C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来 |
| D.国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 |
恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应:
3A(g) 2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
2B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
| A.若x=2,则p>0.5a | B.若x=3,则p<0.7a |
| C.若x=4,则p= a | D.若x= 5,则p≥a |
pH=11的x、y两种碱溶液各5 mL,分别稀释至500 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是
| A.稀释后x溶液中水的电离程度比y溶液中水电离程度小 |
| B.若x、y是一元碱,则等物质的量浓度的y的硝酸盐溶液的pH比x的硝酸盐溶液大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x、y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、、NO的物质的量之比为1﹕1﹕1时,实际参加反应的FeS与HNO3的物质的量之比为
| A.1:7 | B.2:7 | C.1:5 | D.2:9 |
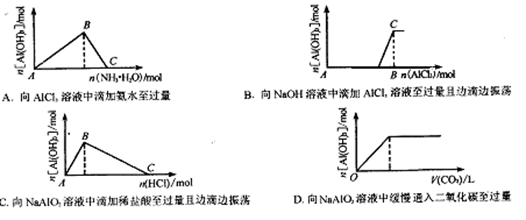
下图所示的实验过程中产生的现象与对应的图形不相符合的是