近年来我国的航天事业取得了巨大的成就,在航天发射时,常用肼(N2H4)及其衍生物作火箭推进剂。
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每克肼充分反应后生成氮气和气态水放出热量为a KJ,试写出该反应的热化学方程式 ;
(2)在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。在蒸馏过程中需要的仪器有酒精灯、锥形瓶、冷凝管、牛角管(接液管)、蒸馏烧瓶,除上述必需的仪器外,还缺少的玻璃仪器是 ;
(3)肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。
(4)磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO; 假设2. 黑色粉末是Fe3O4;
假设3. 。
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若溶液显蓝色,则假设1成立。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向②所得溶液加入足量铁粉,若有红色固体析出的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若假设3成立,则产生红褐色沉淀,同时溶液呈深蓝色。
(1)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。)
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g)△H="+67.7" kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol
则肼与二氧化氮反应的热化学方程式为:
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O。酸式氢氧燃料电池的电解质溶液是强酸溶液,其负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e一=4OH一,则其负极反应式为
短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子。回答:
(1)写出各元素的符号:ABCDEF
(2)写出B与C形成的化合物的电子式
(3)请写出元素F的价电子排布式
(4)上述六种元素按电负性从小到大的排列是(写元素符号)。
(5)C、D、E、F元素第一电离能最大的是(写元素符号);
(6)C、D、E、F四种元素中,形成的最高价氧化物对应水化物中(写化学式):
酸性最强的是碱性最强的是呈两性的是
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)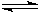 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题
(1)上述正向反应是:反应(选填:放热、吸热)。
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有(选填A、B、C、D、E)。
| A |
B |
C |
D |
E |
|
| n(CO2) |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:C(s)+CO2(g) 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) CO(g)+H2(g)平衡常数K1;
CO(g)+H2(g)平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K2 ,
H2(g)+CO2(g)平衡常数K2 ,
则K、K1、K2之间的关系是:K=。
某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题: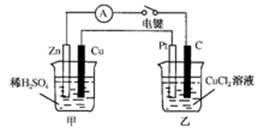
(1)甲装置的名称是_______;乙装置的名称是_______;Zn为_______极;Pt为______极。
(2)写出电极反应式:Cu极________________;C极________________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色______(填“变深”、“变浅”或“无变化”)。
(4) 若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”、“减小”或“不变”,下同);乙中溶液的pH将________。
下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。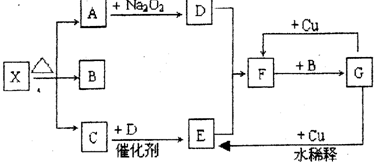
(1)写出下列各物质的化学式:
X:;F:;G:。
(2)写出下列变化的离子方程式:
F→G:;
G→E:。
(3)实验室里,C常采用法来收集。