一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇: CO(g)+2H2(g) CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是
CH3OH(g)。如图是该反应在不同温度下CO的转化率随时间变化的曲线。下列判断正确的是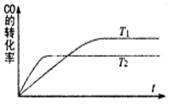
| A.T1>T2 |
| B.该反应的△H >0 |
| C.T1时的平衡常数K1> T2时的平衡常数K2 |
| D.T1时的平衡常数K1< T2时的平衡常数K2 |
已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+O2(g)=2H2O(g)△H2
C(s)+O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为()
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
| A.+43.5kJ·mol-1 | B.-43.5kJ·mol-1 | C.+67.7kJ·mol-1 | D.-67.7kJ·mol-1 |
下列说法正确的是()
| A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
| B.CH4、NH3、PH3的热稳定性逐渐增强 |
| C.因为酸性:HC1>HF,所以非金属性:Cl>F |
| D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱 |
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
| 元素代号 |
原子半径/nm |
主要化合价 |
| X |
0.160 |
+2 |
| Y |
0.143 |
+3 |
| Z |
0.102 |
+6、-2 |
| L |
0.099 |
+7、-1 |
| M |
0.077 |
+4、-4 |
| Q |
0.074 |
-2 |
A.等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
下列各元素的原子在形成不同物质时,既能形成非极性键,也能形成极性键,还能形成离子键的是( )。
| A.Na | B.Fe | C.C | D.Ne |