(共14分)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为 。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
| A.3v(H2)正=2v(NH3)逆 |
| B.单位时间生成m mol N2的同时消耗3m mol H2 |
| C.容器内的总压强不再随时间而变化 |
| D.混合气体的密度不再随时间变化 |
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
| 压强/MPa |
16.80 |
14.78 |
13.86 |
13.27 |
12.85 |
12.60 |
12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) ="=" NH2CO2 NH4(s) △H=" —l59.5" kJ/mol
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol
CO(NH2)2(s)+H2O(g) △H="+116.5" kJ/mol
③H2O(1) ="=" H2O(g) △H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
选修《化学与技术》
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
⑴该泉水属于硬水(填写“暂时”或“永久”)。
⑵若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加后加,原因是。
⑶目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂则水中的Ca2+、Mg2+与交换树脂的起离子交换作用。若使用NaR作为阳离子交换树脂失效后可放入5%-8%溶液中再生。
⑷岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指(填A或B)。
②写出通电后阳极区的电极反应式:;
阴极区的现象是:。
( 14分)在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g) + Y(g) a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为。
(2)写出该反应平衡常数K的表达式 (a必须用具体的值表示)。
(a必须用具体的值表示)。
(3)下列说法中能说明该反应达到了化学平衡状态的是。
A.容器内压强一定 B.容器内气体的密度一定
C.容器内Z分子数一定 D.容器内气体的质量一定
(4)X的转化率α= ,Y的平衡浓度为。(均用含Q、Q1的代数式表示)
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1kJ的是(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
已知A为一无机盐,C 、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为高中常见的单质,I为常见无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。
(1)写出G的电子式_______________,M的化学式_____________;
(2)写出反应②的离子反应方程式______________________________;
(3)写出反应③的化学反应方程式_____________;反应1-4中属于非氧化还原反应的是;
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极___________________
阳极___________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为B:C:D:E:F=1:2:2:2:2,写出A分解的反应方程式__________________________
过碳酸钠(2Na2CO3·3H2O2)是一种新型高效固体漂白杀菌剂,它具有无臭、无毒、无污染的特点,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中。依托纯碱厂制备过碳酸钠可降低生产成本,其生产流程如下: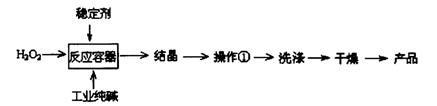
试回答下列问题:
(1)过碳酸钠溶于水后所得溶液一定显(“酸性”、“碱性”或“中性”)。
(2)操作①需要的玻璃仪器有(填写仪器名称)。
(3)工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中Na2CO3的含量。
①要检验工业纯碱中杂质的存在,最好选用下列试剂中的(选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰化钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈 漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若,说明装置不漏气。
漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若,说明装置不漏气。
③装置A的作用是,装置C中的试剂为。
④某同学认为在D装置后应再连接E装置(装有适当试剂),你认为是否必要?
(选填“必要”或“不必要”),判断的理 由是。
由是。
已知:在25时H2O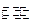 H++OH- KW=10-14
H++OH- KW=10-14
HAC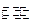 H++A
H++A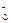 Ka=1.8×10-5
Ka=1.8×10-5
(1)醋酸钠水解的平衡常数Kh的表达式为。当升高温度时,Kh将(填“增大”“减小”“不变”);
(2)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为,a与b的关系为(填“大于”“小于”“等于”);
(3)在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为 0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中能生成沉淀,原因是。(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14、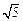 =2.2)
=2.2)