下列反应的离子方程式正确的是( )
| A.碳酸钙跟醋酸反应:CaCO3+2H+===Ca2++H2O+CO2↑ |
B.硫酸铝溶液中加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH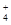 |
| C.向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl- |
D.碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO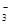 ===BaCO3↓+CO ===BaCO3↓+CO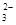 +2H2O +2H2O |
对于反应3Cl2 + 6NaOH =" 5NaCl" + NaClO3 + 3H2O,以下叙述正确的是
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.每生成1mol的NaClO3转移6mol的电子 |
| C.Cl2既是氧化剂又是还原剂 |
| D.被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1 |
24mL浓度为0.05mol・L-1的Na2SO3溶液,恰好与20mL浓度为0.02mol・L-1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
| A.+2 | B.+3 | C.+4 | D.+5 |
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应 ②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应 ③稀硫酸与可溶性钡盐溶液之间的反应 ④氢氧化钡溶液与稀硫酸的反应。上述反应一定可以用离子方程式Ba2++SO42- = BaSO4↓来表示的有几个
| A.0 | B.1 | C.2 | D.3 |
VL Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为
A.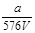 mol/L mol/L |
B.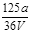 mol/L mol/L |
C.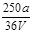 mol/L mol/L |
D.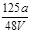 mol/L mol/L |
下列说法正确的是(NA表示阿伏加德罗常数的值):
①28 g氮气所含有的原子数目为NA
②4 g金属钙变成钙离子时失去的电子数目为0.1 NA
③在常温常压下,11.2 L N2含有的分子数为0.5 NA
④在标准状况下, 1 mol氦气含有的原子数为NA
⑤0.5 mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1 L水所含分子数为1/22.4NA
⑦17 g氨气所含电子数目为10NA
| A.①②⑤⑥⑦ | B.①②④⑤⑥ | C.⑤⑦ | D.④⑤⑦ |