锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为( )
| A.2 mol | B.1 mol | C.0.5 mol | D.0.25 mol |
化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是( )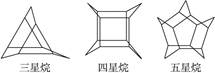
| A.它们之间互为同系物 |
| B.六星烷的化学式为C18H24 |
C.三星烷与丙苯互为同分异构体,四星烷与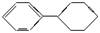 互为同分异构体 互为同分异构体 |
| D.它们的一氯代物均只有两种,而三星烷的二氯代物有四种 |
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是( )
①分子中具有7个碳原子 芳香烃 ②分子中具有4个碳原子的烷烃 ③分子中具有12个氢原子的烷烃 ④分子中具有8个碳原子的烷烃
| A.①② | B.②③ | C.③④ | D.②④ |
2002年瑞典科学家发现,某些高温油炸食品中含有一定量的 (丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:①能使KMnO4酸性溶液褪色,②能发生加聚反应生成高分子化合物,③只有4种同分异构体,④能与氢气发生加成反应。其中正确的是( )
(丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:①能使KMnO4酸性溶液褪色,②能发生加聚反应生成高分子化合物,③只有4种同分异构体,④能与氢气发生加成反应。其中正确的是( )
| A.①②③ | B.②③④ |
| C.①③④ | D.①②④ |
苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如下图。关于苏丹红说法错误的是( )
| A.分子中含一个苯环和一个萘环 |
| B.属于芳香烃 |
| C.能被高锰酸钾酸性溶液氧化 |
| D.能溶于苯 |
分子式为C7H16,主链上为五个碳原子的有机物共有( )
| A.2种 | B.3种 | C.5种 | D.7种 |