下列离子方程式正确的是
| A.钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
B.硅酸钠溶液与醋酸溶液混合: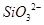 + + |
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:  1 1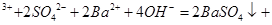 A1 A1 |
D.向次氯酸钙溶液通入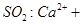 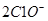 + + |
材料是人类赖以生存的重要物质基础。下列有关材料的说法正确的是
| A.玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都是石灰石 |
| B.钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀 |
| C.聚氯乙烯塑料在日常生活中可用来进行食品包装 |
| D.铝制品在空气中不易被腐蚀,是因为常温下铝不与氧气反应 |
保护环境日益引起人们的重视。下列做法不利于保护环境的是
| A.造纸厂污水没经处理直接排放 | B.推广使用太阳能电池 |
| C.电动汽车代替部分燃油汽车 | D.氢能源代替化石能源 |
下列有机物用于合成聚乙烯塑料,是聚乙烯的单体的是
| A.CH4 | B.CH2=CH2 | C.CH3CH2OH | D.CH2=CHCH3 |
黄铜(Zn-Cu合金)的质地、手感、颜色与黄金十分相似,曾经有很多不法商贩利用黄铜冒充黄金欺骗路人。下列方法中,不能区分黄铜与黄金的是
| A.看外观 | B.用盐酸 | C.测定密度 | D.用火烧 |
白蚁能分泌一种叫做蚁酸的物质,其化学性质与乙酸相似。据此判断,下列物质最不容易被蚁酸腐蚀的是
| A.黄金饰品 | B.镀锌水管 | C.石灰墙面 | D.铝合金门窗 |