(16分)氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”), ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时 mol3
mol3 mol3.L-3).
mol3.L-3).
根据题意回答下列问题
①Fe2+的电子排布式为②基态铜原子简化电子排布式为
③Se价电子排布图为④第二周期第一电离能由小到大的次序为
⑤铬原子的原子结构示意图为
(1)按要求在下列空格中填出下列有机物的有关式子:
相对分子质量最小的有机物电子式,食醋中的有机物结构式,糖尿病患者尿液中含的糖类结构简式。
(2).下面列出了几组物质,请将物质的合适组号填写在空格上。
同位素,同系物,同分异构体。
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;
④氧气(O2)与臭氧(O3);⑤CH4和CH3CH2CH3;
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑦ 和CH3CH2CH2CH2CH3⑧ C(CH3) 4 和
和CH3CH2CH2CH2CH3⑧ C(CH3) 4 和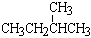
已知在强碱溶液中加热R-Br 容易水解为R-OH,现知某芳香烃A有如下转化关系: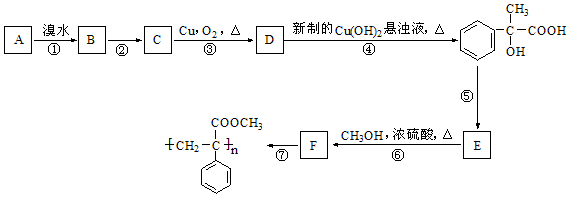
按要求填空:
(1)写出反应②和⑤的反应条件:② ;⑤
(2)写出A和F结构简式:A ;F
(3)写出反应①和⑥的类型:① ;⑥
(4)写出反应③、⑦对应的化学方程式:
③
⑦
新合成的一种烃,其碳架呈三棱柱体(如图所示)
(1)写出该烃的分子式。
(2)该烃的一氯取代物是否有同分异构体。
(3)该烃的二氯取代物有多少种。
(4)该烃的同分异构体有多种,其中1种不能使酸性高锰酸钾溶液或溴水溶液褪色,但在一定条件下能跟溴发生取代反应、与H2发生加成反应,这种同分异构体的结构简式是。
已知乙烯能发生以下转化: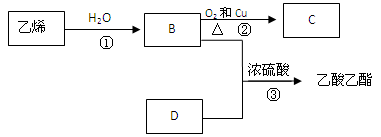
(1)乙烯的结构简式为: 、空间构型为___________.
(2)写出B、D化合物中官能团:B中含官能团;D中含官能团;
(3)写出反应的化学方程式
①反应类型:
②反应类型: