卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的___________区;
(2)氟的电子排布图为___________________;
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是______________;
(4)已知碘酸HIO3和高碘酸H5IO6的结构分别如图I、图II所示:
请比较二者酸性强弱:HIO3_________H5IO6(填“>”“<”或“=”);
(5)下图为碘晶体晶胞结构。下列说法中正确的是_________.
| A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以8配位数交替配位形成层状结构 |
| B.用均摊法可知平均每个晶胞中有4个碘原子 |
| C.碘晶体为无限延伸的空间结构,是原子晶体 |
| D.碘晶体中存在的相互作用有非极性键和范德华力 |
某芳香烃A有如下转化关系: 
⑴ 写出反应②和⑤的反应条件:②;⑤.
⑵ 写出A和F结构简式:A;F.
⑶ 写出反应③对应的化学方程式:.
⑷ 属于取代反应的有(填序号).
⑸ 根据已学知识和获取的信息,以CH3COOH , 为原料合成重要的化工产品
为原料合成重要的化工产品 ,写出相应的合成路线流程图(无机试剂任用)
,写出相应的合成路线流程图(无机试剂任用)
请参考如下形式:

A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
(1)B和C均为有支链的有机化合物,B的结构简式为__________;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为__________________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为________。
(3)写出⑤的化学反应方程式____________________________________________。⑧的化学反应方程式____________________________________________。
(4)①的反应类型________,④的反应类型________,⑦的反应类型________。
(5)与H具有相同官能团的H的所有同分异构体的结构简式为___________________。
金刚烷是一种重要的化工原料,工业上可通过下列途径制备: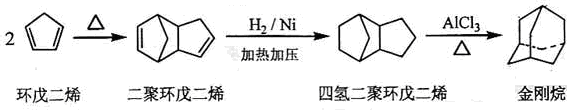
请回答下列问题:
(1)金刚烷的分子式为,其分子中的CH2基团有个;
(2)下面是以环戊烷为原料制备环戊二烯的合成路线: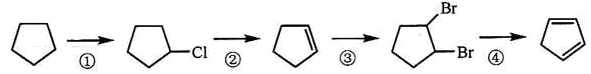
其中,反应①的反应试剂是,反应③的方程式,反应④的反应类型是;
(3)已知烯烃能发生如下的反应: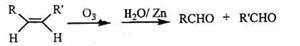
请写出下列反应产物的结构简式: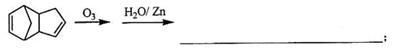
下列3种有机化合物A: CH2=CH-CH3 B: C:CH3CH2OH
C:CH3CH2OH
(1)写出化合物A、C中的官能团的名称、。
(2)A在催化剂加热条件下聚合生成聚合物的反应方程式为,反应类型为。
(3)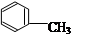 在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:。
在浓硫酸作用下,与浓硝酸共热至100℃反应的化学方程式为:。
(4)B可以被酸性高锰酸钾氧化成苯甲酸,写出苯甲酸与C物质与浓硫酸共热发生酯化反应的化学方程式:。
除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
| 混合物 (括号内为少量杂质) |
试剂 (足量) |
分离方法 |
|
| A |
苯(苯酚) |
||
| B |
乙烯(SO2) |
||
| C |
乙酸乙酯(乙酸) |
||
| D |
乙醇(水) |