向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是
| A.OH―+CO32―+2H+→HCO3―+H2O | B.2OH―+CO32―+3H+→HCO3―+2H2O |
| C.2OH―+CO32―+4H+→CO2↑+3H2O | D.OH―+CO32―+3H+→CO2↑+2H2O |
1999年曾报导合成和分离了含高能量的正离子N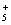 的化合物N5AsF6,下列叙述错误的是
的化合物N5AsF6,下列叙述错误的是
A.N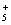 共有34个核外电子 共有34个核外电子 |
B.N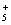 中氮-氮原子间以共用电子对结合 中氮-氮原子间以共用电子对结合 |
| C.化合物N5AsF6中As化合价为+1 |
| D.化合物N5AsF6中F化合价为-1 |
已知某粒子的质子数,则可确定的
| A.中子数 | B.最外层电子数 | C.核电荷数 | D.相对原子质量 |
某原电池总反应是Zn+Cu2+=Zn2++Cu,该原电池组成及判断正确的是
| A |
B |
C |
D |
|
| 正极 |
Zn |
Cu |
Zn |
Cu |
| 负极 |
Cu |
Zn |
Cu |
Zn |
| 电解质溶液 |
CuCl2 |
CuCl2 |
ZnCl2 |
ZnCl2 |
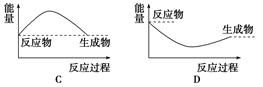
下列各图中,表示正反应是吸热反应的图是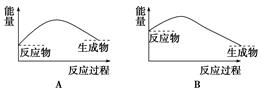
可逆反应A(g)+3B(g) 2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A.v(A)=0.15mol/(L·min) B.v (B)=0.6 mol/(L·min)
C.v (C)=0.3 mol/(L·min) D.v (D)=0.1 mol/(L·min)