(9分) 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为__________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为______(填化学式)。
③NaH2PO2为___________(填“正盐”或“酸式盐”),其溶液显_______(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应,写出白磷与Ba(OH)2溶液反应的化学方程式_______________________。
(10分)按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是
(2)用电子式表示下列化合物的形成过程
H2S;MgF2
(3)写出2,2,4—三甲基-3-乙基庚烷的结构简式:
(4)写出(CH3)2CHCH(CH3)(CH2)3CH3 的名称:
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置 _______________
(2)工业合成BA3的化学方程式为 ____________________________________________
(3)D2C2含有的化学键是 _______________________________
(4)由A、B、C三种元素形成的离子化合物与强碱溶液反应的离子方程式是_________
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为(化学式用具体的元素符号表示)_______________________
由阴阳离子通过离子键结合而成的晶体称为离子晶体,离子化合物固态时一般为晶体,在离子晶体中,阴、阳离子按一定规律在空间排列。下图是NaCl晶体的晶胞结构。(空心点为Cl—,实心球为Na+)
(1)在NaCl晶体中,每个Na+离子同时吸引着_______个Cl—离子,在周围与它最接近且等距离的Cl—共有___________个,Cl—离子位于Na+围成的___________体中心,而Na+离子数目与Cl-离子数目之比为___________。
(2)若CuO晶体中O2-采取NaCl晶胞结构中Na+的堆积方式,Cu2+占据O2-围成的正四面体空隙,则Cu2+占据O2-围成的正四面体空隙的占据率为 __________。
在离子晶体中,阴、阳离子具有或接近具有球形对称的电子云,它们可以被看成是不等径的刚性圆球,并彼此相切(如下图),离子键的键长是相邻阴、阳离子的半径之和(如下图)。已知a为常数。试回答下列问题: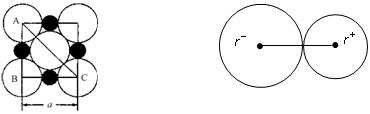
NaCl晶体中微粒间排布 NaCl晶体中离子键键长
(3)NaCl晶体离子键的键长为____________。
(4)Na+离子半径与Cl-离子半径之比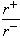 =_______________。
=_______________。
(已知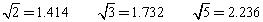 )
)
(5)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形成存在,现在29.25g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为____________。
(10分)已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 ___(填“>”、“<”或“=”)570 kJ
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量
的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4完全燃烧生成CO2
气体和H2O(l)的热化学方程式为 ____________________________________ 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极
均由多孔的碳块组成。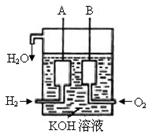
该电池的正极为:__________(填A或B)。若该电池工作时增加了1mol H2O,电
路中转移电子的物质的量为 ____________ 。
(4)如果将上述装置中通往的H2改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KKOH=K2CO3+3H2O,则该电池的负极反应式为:
______________________________________。
物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中A、H为常见的金属单质,气体D、E为单质,试回答: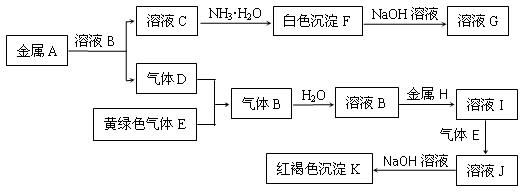
(1)A元素的原子结构示意图为 ________________
(2)写出下列物质的化学式:E是____________ , K是 _________
(3)化合物B属于 ____________化合物(填“离子”或“共价”)
(4)写出反应“F→G”的化学方程式:________________________________________
(5)写出反应“I→J”的离子方程式:_________________________________________