a mol N2与b mol H2混合,要一定条件下反应达到平衡,生成了c mol NH3,则NH3在平衡体系中质量分数为( )
A.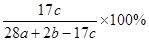 |
B.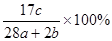 |
C. |
D.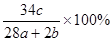 |
今有一个多肽,分子式为C60H77N11O22,将其彻底水解后只得到四种氨基酸:甘氨酸(C2H5NO2)、丙氨酸(C3H7NO2)、苯丙氨酸(C9H11NO2)、谷氨酸(C5H9NO4,含2个羧基),该多肽水解后得到的谷氨酸分子数为
| A.4 | B.8 | C.2 | D.5 |
6 g某醛跟足量的银氨溶液反应,结果析出86.4 g银,则该醛是
| A.甲醛 | B.乙醛 | C.丙醛 | D.丁醛 |
有机物A的分子式为C3H6O2,水解后得到一元酸M和一元醇N,已知M、N的相对分子质量相等,则下列叙述中不正确的是
| A.N、M均不能发生银镜反应 |
| B.M中没有甲基 |
| C.M、N分子的红外光谱中都存在O-H的信息 |
| D.N分子能发生消去反应 |
分子式为C5H12O且可被氧化生成醛的有机物有(不考虑立体异构)
| A.3种 | B.4种 | C.5种 | D.6种 |
下列反应属于有机物发生还原反应的是
A.新制氢氧化铜与乙醛反应 B.油脂的氢化反应
B.乙酸乙酯水解 D.油脂的皂化反应