电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO+5I-+3H2O,下列说法不正确的是( )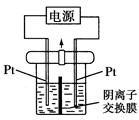
| A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- |
| B.电解结束时,右侧溶液中含有IO3- |
C.电解槽内发生反应的总化学方程式:KI+3H2O KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 |
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是
| 元素代号 |
A |
B |
C |
D |
E |
F |
| 原子半径/nm |
0.186 |
0.143 |
0.160 |
0.102 |
0.074 |
0.099 |
| 主要化合价 |
+l |
+3 |
+2 |
+6、﹣2 |
﹣2 |
+7、﹣1 |
A.元素D位于第三周期Ⅵ族
B.A、B、C三种元素的最高价氧化物对应水化物的碱性依次增强
C.1 molF的单质参加氧化还原反应时转移的电子数一定为2 mol
D.元素B、E形成的化合物具有两性
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
| A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同 |
| B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强 |
| C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO |
| D.根据常温下铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2 |
用来表示可逆反应2A(g)+B(g) 2C(g)△H<0的正确图像是
2C(g)△H<0的正确图像是
下列说法或表示法正确的是
| A.在稀溶液中:H++OH﹣=H2O;△H=﹣57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
| B.由4P(s,红磷)===P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 |
| C.已知2H2(g)+O2(g)==2H2O(g);△H=﹣483.6kJ·mol﹣1,则H2的燃烧热等于241.8 kJ·mol﹣1 |
| D.己知:S(g)+O2(g)===SO2(g);△H1及S(s)+O2(g)===SO2(g):△H2,则△H1<△H2 |
关于原子结构、元素性质的说法正确的是
| A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.在化学反应中,原子首先失去的电子能量最低 |
| D.在元素周期表中,各主族元素的最高化合价与其族序数相等 |