下列各类有机物:①饱和一元醇 ②饱和一元醛 ③饱和一元羧酸 ④饱和一元醇与饱和一元酸生成的酯 ⑤乙炔的同系物 ⑥苯的同系物 ⑦乙烯的同系物,完全燃烧时产生的水和二氧化碳的物质的量之比恒定的是
| A.①③⑤⑦ | B.①④⑥ | C.②③④⑦ | D.②③④⑤⑥ |
大米久置后易霉变而产生黄曲霉毒素(AFTB),其分子结构式如右图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。一般条件下跟1mol AFTB起反应的NaOH或H2的最大量分别是
A.1mol;5molB.1mol; 6mol
C.2mol;5molD.2mol; 6mol
A、B、C都是有机化合物,且有如下转化关系:A B
B C。A的相对分子质量比B大2,C的相对分子量比B大16,C能与NaOH反应,以下说法正确的是
C。A的相对分子质量比B大2,C的相对分子量比B大16,C能与NaOH反应,以下说法正确的是
A. A是乙烯,B是乙烷 B. A是乙炔,B是乙烯
C. A是环己烷,B是苯 D. A是乙醇,B是乙醛
药物可以预防、诊断和治疗疾病,而中学化学中不少常用化学试剂本身就具有药物的功效,如酚酞医药名为果桃, 酚酞含片是一种治疗消化系统疾病的药物,其有效成分的结构简式如图所示。下列对该有效成分的说法正确的是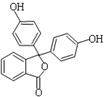
| A.所有原子可能共平面 |
| B.酚酞的水解产物中含有醇羟基 |
| C.能发生加聚反应生成高分子化合物 |
| D.1 mol该物质最多能与含4 molNaOH的烧碱溶液反应 |
下列各组有机物只用一种试剂无法鉴别的是
| A.甲苯、乙醇、溴苯 | B.苯、甲苯、环己烷 |
| C.甲酸、乙醛、乙酸 | D.苯、苯酚、己烯 |