已知常温下反应①NH3+H+ NH
NH (平衡常数为K1),②Ag++Cl-
(平衡常数为K1),②Ag++Cl- AgCl(平衡常数为K2),③Ag++2NH3
AgCl(平衡常数为K2),③Ag++2NH3 Ag(NH3)
Ag(NH3) (平衡常数为K3)。
(平衡常数为K3)。
①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是
| A.氯化银不溶于氨水 |
| B.银氨溶液中加入少量氯化钠有白色沉淀 |
| C.银氨溶液中加入盐酸有白色沉淀 |
| D.银氨溶液可在酸性条件下稳定存在 |
下列说法错误的是
A.在化合物 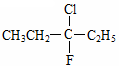 中,存在手性碳原子 中,存在手性碳原子 |
| B.原子间形成分子时,决定各原子相互结合的数量关系的是共价键的饱和性 |
| C.根据对角线规则判断Be(OH)2是两性氢氧化物 |
| D.在相同条件下,邻羟基苯甲醛的沸点高于对羟基苯甲醛 |
下列叙述错误的是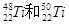
| A.在周期表中位置相同,都在第4纵行 |
B.CO2的分子模型: |
| C.在CS2、PCl3中各原子最外层均能达到8电子的稳定结构 |
| D.HF、HCl、HBr、HI的稳定性依次增强 |
应用元素周期律,判断下列语句,其中正确的组合是
①金属单质Li、Na、K的熔点随原子序数的增大而升高
②砹(At)是第VIIA族,其氢化物的稳定性小于HC1
③硒(Se)是第VIA族,其最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,其水溶液均为酸性
⑤铊(TI)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
| A.①③④ | B.①③⑥ | C.③④⑤ | D.②③⑥ |
下列事实,不能用氢键知识解释的是
| A.水和乙醇可以完全互溶 | B.溴化氢比碘化氢稳定 |
| C.干冰易升华 | D.液态氟化氢的化学式有时可以写成(HF)n的形式 |
下列关于杂化轨道的叙述中,不正确的是
| A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子 |
| C.[Cu(NH3)4]2+和CH4两个分子中中心原子Cu和C都是通过sp3杂化轨道成键 |
| D.杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾 |