(实验班)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) 0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) −c (M+)= mol·L-1,c (H+) −c (MOH) = mol·L-1。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH 7(填“>、<或=”)。
有A、B、C、D、E5种元素,已知:
① A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子第三层上的电子比第一层多5个。
② 常温下B2是气体,它对氢气的相对密度是16。
③ C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④ D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1) A是________、B是________、C是________、D是________、E是________。(写元素符号)
(2) E的原子结构示意图为________________,C的离子结构示意图为________________。
(3) F和AB2反应的化学方程式为。
推断元素(以下各题所涉及的元素均在前20号)
①最外层有一个电子的元素是。
②最外层有两个电子的元素是。
③最外层电子数等于次外层电子数的元素是。
④最外层电子数等于次外层电子数两倍的元素是。
⑤最外层电子数等于次外层电子数三倍的元素是。
⑥最外层电子数等于次外层电子数四倍的元素是。
⑦电子层数与最外层电子数相等的元素是。
⑧电子层数为最外层电子数2倍的元素是。
⑨次外层电子数是最外层电子数2倍的元素是。
已知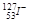 ,求它的Z、N、A、e分别是、、、。
,求它的Z、N、A、e分别是、、、。
根据下列叙述,写出元素名称并画出原子结构示意图。
①A元素原子核外M层电子数是L层电子数的一半。
②B元素原子的最外层电子数是次外层电子数的3/2倍。
③C元素的单质在常温下就能与水剧烈反应,产生的气体能使带火星的木条复燃。该反应的化学方程式为。
④D元素原子的次外层电子数是最外层电子数的1/4。
某元素原子的一价阳离子的核外有18个电子,质量数为40,该元素原子的原子核内中子数为。