下列说法正确的是()
| A.同体积、同密度的C2H4和C3H6所含原子数一定相等 |
| B.同主族元素的最高正价都相同 |
| C.CH3COONa和NaOH中化学键类型完全相同 |
| D.最外层有5个电子的原子都是非金属原子 |
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42—)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
| A.全部 | B.③⑤⑥ | C.④⑤⑥ | D.①②④ |
下列说法不正确的是( )
| A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
下列说法正确的是( )
| A.pH=4的溶液中水电离出的H+一定是1×10-4mol/L |
| B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸<VNaOH |
| C.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl) |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)=c(HCO3—) |
| C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是( )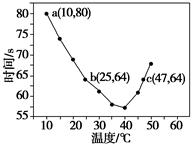
| A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0×10-5 mol·L-1·s-1 |
| D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂 |