氨是最重要的氮肥,是产量最大的化工品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或 “等于”)原来的2倍。
油脂在________条件下水解发生皂化反应;坏血病是缺乏___ _____所引起的,儿童缺乏维生素D时易患_____ ___;铁是_____ ___ __的主要组成成分,对维持人体所有细胞正常的生理功能是十分必要的。
我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3),据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一()
A、胰岛素
B、甲状腺素
C、生长激素
D、雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患()
A、甲状腺亢进
B、贫血症
C、地方性甲状腺肿
D、糖尿病
(3)可用盐酸酸化的碘化钾淀粉溶液,检查食盐中含碘酸钾。反应的化学方程式为 。可观察到的明显现象为 。
食物所供应的广大营养素中, 、 和 能在人体中 (填“氧化” 或“还原” ),供给人体所需要的能量。
某溶液含有Ba2+、 Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案):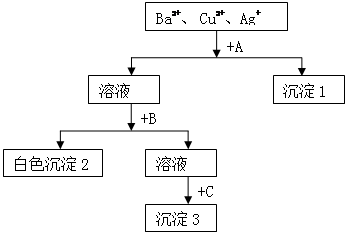
(1)所加试剂的化学式:A_________ 、C_________ _
(2)生成沉淀3的离子方程式_________________________ ____
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。
(1)实验室里将粗盐制成精盐的过程中,有溶解、过滤、蒸发三个主要步骤。这三步操作中都要用到玻璃棒,说明下列情况下使用玻璃棒的目的;
溶解时:_______ _ _;
过滤时:_____ _;
(2)经过过滤的食盐水仍含有钙离子、镁离子、硫酸根离子等可溶性杂质,通过如下几个步骤,可制得纯净的食盐水。正确的操作顺序可以为 ② ⑤④。
①加入稍过量的Na2CO3溶液 ②加入稍过量的NaOH溶液 ③加入稍过量的BaCl2溶液 ④滴入稀盐酸至无气泡产生 ⑤过滤
(3)Na2CO3溶液与BaCl2溶液反应的离子方程式为_________________________