已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3
ΔH=—92.4 KJ/mol,则N≡N键的键能是
| A.431 KJ/mol | B.946 KJ/mol | C.649 KJ/mol | D.869 KJ/mol |
关于下列各图的说法,正确的是()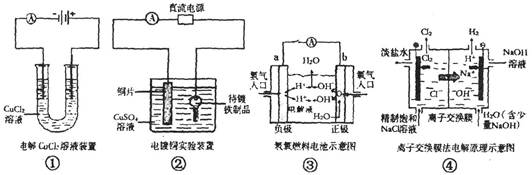
| A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体 |
| B.②中待镀铁制品应与电源正极相连 |
| C.③中电子由b极流向a极 |
| D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
下列图示与对应的叙述相符的是()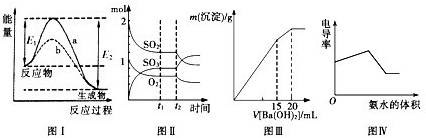
| A.图I表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时铝离子恰好沉淀完全 |
| D.电导率可表示溶液导电性的强弱,电导率越大导电性越强。图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系 |
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是()
PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是()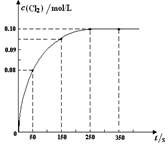
| A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s) |
| B.该温度下,反应的平衡常数K = 0.025(不考虑单位) |
| C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0 |
| D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L |
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是()
| A.c(NH4+):③ > ② |
| B.pH:① > ② > ③ |
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动 Mg2+ (aq) + 2OH- (aq)向溶解方向移动 |
| D.等体积①和③混合溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-) |
已知化学键能:Si—Si:M KJ/mol O=O:N KJ/mol Si—O:Q KJ/mol,则Si (s) + O2 (g) =SiO2 (s); ΔH=()
| A.—(4Q—2M—N)KJ/mol | B.—(4Q—M—2N)KJ/mol |
| C.—(2Q—M—2N)KJ/mol | D.—(2Q—2M—N)KJ/mol |