某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32―、Cl一、SO42―,为确认溶液组成,现取100 mL分成三等份溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58 g,同时收集到气体0.03 mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。由此可知,下列关于原溶液组成的正确结论是( )
| A.一定存在Cl一 | B.溶液中含有A13+和NH4+ |
| C.一定不存在Mg2+,可能存在A13+ | D.溶液中SO42―的浓度是0.03 mol/L |
下列有关钠的叙述正确的是
| A.钠在空气中燃烧生成氧化钠 |
| B.钠元素在自然界中可以以游离态形式存在 |
| C.少量金属钠可以保存在煤油中 |
| D.金属钠投入硫酸铜溶液中有铜生成 |
下列气体中,不能用排水法收集的是
| A.NO2 | B.NO | C.O2 | D.H2 |
除去混在Na2CO3粉末中的少量NaHCO3,下列最合理的方法是
| A.加入适量NaOH溶液 | B.加热到固体质量不变 |
| C.加入适量HCl溶液 | D.加入适量CaCl2溶液 |
下列说法正确的是
| A.浓硝酸应保存于无色试剂瓶中 |
| B.碘是人体必需的微量元素,所以要多吃富含I2的食物 |
| C.二氧化硫可广泛用于食品的增白 |
| D.次氯酸钠溶液可用于环境的消毒杀菌 |
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应类型属于阴影部分的是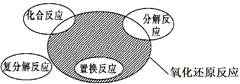
| A.2Na2O2+2H2O=4NaOH+O2↑ |
B.NH4HCO3 NH3↑+CO2↑+H2O NH3↑+CO2↑+H2O |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.Br2+2KI=I2+2KBr |