已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,其中A与C可形成化学式为A2C,A2C2的化合物,D的最高价氧化物对应水化物呈强碱性,B与E可形成直线型分子且每个原子最外层都满足8电子稳定结构,则下列说法正确的是
A.原子半径:D>E>B>C>A
B、工业上制取单质D是采用电解D的熔融氧化物
C.D与E形成的化合物溶于水呈弱酸性
D.C与D形成的化合物与D、E形成的化合物,化学键类型一定相同
镁—H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是
| A.电池总反应为Mg+H2O2 = Mg(OH)2 |
| B.正极发生的电极反应为H2O2+2H++2e- = 2H2O |
| C.工作时,正极周围海水的pH减小 |
| D.电池工作时,溶液中的H+向负极移动 |
下列关于电解质溶液的叙述正确的是
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:c (Cl-) > c (NH4+) > c (H+)> c (OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
在1L密闭容器中,把l mol A和1 mol B混合发生如下反应:
3A(g) + B(g)  XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
| A.x的值为2 | B.A的转化率为40% |
| C.B的平衡浓度为0.8 mol/L | D.达到平衡时D的体积分数为20% |
有关右图装置中的叙述正确的是 
| A.这是电解NaOH溶液的装置 |
| B.这是一个原电池装置 |
| C.Pt为负极,其电极反应为:O2+2H2O+4e-= 4OH- |
| D.Fe为阳极,其电极反应为:Fe-2e-+2OH- = 2Fe(OH)2 |
一定条件下,可逆反应C(s)+CO2(g) 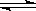 2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
| A.①②③④ | B.①③ | C.②④ | D.①③④ |