某二价金属的碳酸盐和酸式碳酸盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和酸式碳酸盐的物质的量之比是 ( )
| A.1:1 | B.1:2 | C.1: 3 | D.1:4 |
下列选项中所涉及的两个量一定相等的是
| A.6.2 g Na2O和7.8 g Na2O2中所含的离子数 |
| B.电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| C.11.2 L N2与14 g CO气体所含有的原子数 |
| D.20 g重水(D2O)与17 g NH3所含有的电子数 |
下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH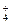 ) ) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.0.1 mol·L 的硫酸铵溶液中:c(NH 的硫酸铵溶液中:c(NH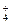 )>c(SO )>c(SO )>c(H+) )>c(H+) |
D.0.1 mol·L 的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2C(H2S) 的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+2C(H2S) |
下列各组离子一定能大量共存的是
| A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| B.在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C.在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、SO42-、NO3- |
| D.在PH=1的溶液中:K+、Fe2+、Cl-、NO3- |
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用滴定管量取液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.①③⑤⑥ | B.①②⑤⑥ | C.②③④⑥ | D.③④⑤⑥ |
下列反应的离子方程式正确的是
| A.用惰性电极电解MgCl2溶液: 2Cl? + 2H2O ="=" Cl2↑+H2↑+2OH? |
| B.硫化钠发生水解: S2?+H2O = HS?+OH? |
| C.少量小苏打溶液滴入Ba(OH)2溶液中:HCO?3 + Ba2+ + OH?- = BaCO3↓+H2O |
| D.向NH4HSO4溶液中加入NaOH溶液至混合液为中性:H++OH?= H2O |