(12分)碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO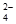 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下: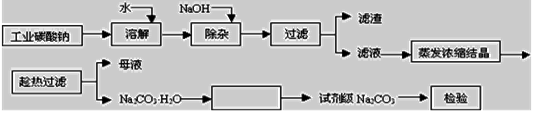
已知碳酸钠的溶解度(S)随温度变化的曲线如图所示:
回答下列问题:
(1)滤渣的主要成分为_________________________。
(2)“趁热过滤”的原因是______________________。
(3)在实验室做Na2CO3·H2O脱水实验,判断其脱水完全的方法是:__________。
(4)生产过程中“母液”____(填“能”或“不能”)循环使用。若不能,其原因是:_________。
(5)已知:①Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g);ΔH1=" +532.36" kJ·mol-1
②Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g);ΔH2=" +473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式_____________________。
2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
(1)图中A、C分别表示__________、__________,E的大小对该反应的反应热有无影响?____________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________。
(2)图中ΔH=__________kJ/mol;
(3)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=____mol/(L·min)
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=_。
把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g)=CO2(g)△H1<0①
途径II:先制成水煤气:C(s) +H2O(g)=CO(g)+H2(g)△H2>0②
再燃烧水煤气:2CO(g)+O2 (g)=2CO2(g)△H3<0③
2H2(g)+O2 (g)=2H2O(g)△H4<0④
请回答下列问题:
(1)途径I放出的热量( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2)△H1、△H2、△H3、△H4的数学关系式是。
(3)12g炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为。
(4)煤炭作为燃料采用途径II的优点有。
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)在容量瓶的使用方法中,下列操作不正确的是____________(不定项选择)
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。 |
(3)甲、乙两同学欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①每位同学各需要量取________mL上述浓盐酸进行配制。(保留小数点后一位)
②在配制过程中,甲同学存在以下不正确操作,对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
③乙同学转移溶液时操作如图所示,其中存在的错误是____________________________________________。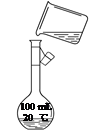
(1)在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,_________是氧化剂, _______是还原剂,HCl表现的性质是_______和________,1mol K2Cr2O7反应转移电子的物质的量是_________。
(2)下列物质中①食盐水②NaOH ③Cu ④HCl气体⑤空气 ⑥酒精 ⑦CO2⑧KNO3属于电解质的是(填序号,下同);属于非电解质的是。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究过氧化氢的性质。
请填写下列空白:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。 MnO4-+
MnO4-+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ O2+
O2+
(3)滴定时,将高锰酸钾标准溶液注入____________(填“酸式”或“碱式”)滴定管中。
如何判断滴定到达终点:
。
(4)如图表示25 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)________。
| A.是a mL | B.是(25-a)mL | C.一定大于a mL | D.一定大于(25-a)mL |
(5)重复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_________________。
(6)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果________(填“偏高”或“偏低”或“不变”)。