下列说法正确的是
A.用CuCl2溶液做导电性实验时灯泡发光:CuCl2 Cu2+ +2Cl- Cu2+ +2Cl- |
| B.2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O是氧化还原反应 |
| C.HClO中氯元素化合价比HClO4中氯元素化合价低,所以HClO4的氧化性强 |
| D.将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为下图 |
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应为: ;
;
有关此电池的推断错误的是
| A.通乙烷的电极为负极 |
B.参加反应的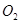 与 与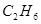 的物质的量之比为7:2 的物质的量之比为7:2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
D.在电解质溶液中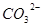 向正极移动 向正极移动 |
下列各表述与示意图一致的是
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2mol/L |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0; |
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g) Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,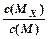 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是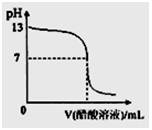
| A.pH=7时,所加醋酸溶液的体积为10mL |
| B.pH<7时,溶液中:c(CH3COO-)>c(Na+) |
| C.7<pH<13时,溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1 |
下列化学原理表述正确的是
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大; |
| B.Na2CO3溶液中满足:c(Na+)=2c( CO32-)+2 c( HCO3-)+ 2c (H2CO3) |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多; |