下列各反应对应的离子方程式正确的是( )
| A.次氯酸钠溶液中通入过量二氧化硫ClO- + H2O + SO2 = HClO+ HSO3- |
| B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3-+ Ca2++2OH-= CaCO3↓+2H2O+CO32- |
| C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH-+ H++SO42—= BaSO4↓+H2O |
| D.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S 5OH- + 3H2S = HS—+ 2S2- + 5H2O |
下列物质不会造成大气污染的是
| A.二氧化硫 | B.氮气 | C.一氧化碳 | D.氮氧化物 |
垃圾处理无害化、减量化和资源化逐渐被人们所认识。垃圾的分类 收集是实现上述理念的重要措施。某垃圾箱上贴有如图所示的标志,向此垃圾箱中丢弃的垃圾是
收集是实现上述理念的重要措施。某垃圾箱上贴有如图所示的标志,向此垃圾箱中丢弃的垃圾是
| A.危险垃圾 | B.可回收物 | C.有害垃圾 | D.其他垃圾 |
下列物质的主要成分属于天然纤维素的是
| A.聚乙烯 | B.尼龙 | C.棉花 | D.涤纶 |
下列元素中属于人体生命活动必需的微量元素的是
| A.H | B.O | C.Fe | D.Na |
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是
①浓H2SO4②NaOH溶液③饱和NaCl溶液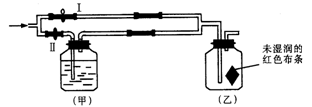
| A.①③ | B.③ | C.①② | D.②③ |