我国安徽盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子),下列有关说法正确的是
| A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2 |
| B.工业上通过电解氯化钠溶液制备金属钠和氯气 |
| C.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液 |
| D.室温下,AgCl在水中的溶解度小于在食盐中的溶解度 |
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示, 其中T单质和H2在光照的条件下发生爆炸。则下列判断正确的是
| A.五种元素中Z的活动性最弱,T 的氧化物对应水化合物酸性最强 |
| B.氢化物的稳定性:R>Q>X;R>T>X |
| C.Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质 |
| D.X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
化学与社会、生产、生产密切相关。下列说法错误的是
| A.油脂和草木灰的混合物有一定的去污能力,在热水中去污能力更强 |
| B.胶体粒子吸附电荷是胶体相对稳定的主要原因,中和所带电荷可以使胶体聚沉 |
| C.在船底镶嵌锌块以保护船体的方法叫阴极电保护法,利用的是原电池原理 |
| D.过多的汽车尾气排放物容易造成雾霾、酸雨和光化学污染等环境污染问题 |
仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的的是
| 选项 |
实验目的 |
仪器 |
| A |
除去氢氧化铝胶体中的泥沙 |
漏斗(带滤纸)、烧杯、玻璃棒 |
| B |
从食盐水中获得NaCl晶体 |
坩埚、玻璃棒、酒精灯、泥三角 |
| C |
用0.10mol·L-1的盐酸测定未知浓度的NaOH溶液浓度 |
碱式滴定管、酸式滴定管、锥形瓶、胶 头滴管、烧杯 |
| D |
用MnO2和浓盐酸制取干燥、纯净 的Cl2 |
圆底烧瓶、分液漏斗、酒精灯、洗气瓶、 集气瓶、导管、石棉网 |
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,归纳正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有
c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka,醋酸根水解平衡常数为Kh,水的离子积为Kw,则有:
Ka∶Kh=Kw
| A.①④ | B.①②④ | C.②③ | D.③④ |
利用如图装置,完成很多电化学实验。下列有关此装置的叙述中,正确的是()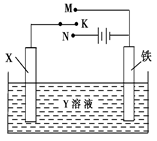
| A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 |
| B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阴离子向铁电极移动 |
| C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 |
| D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 |