硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700 g样品,配制成100.00 mL溶液A。②准确量25.00mL 溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 0mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥_______mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4-被还原为MnO2,其离子方程式为 。
(3)通过上述实验事实,该样品的组成为(写化学式) 。
(4)上述实验③KMnO4溶液滴定至终点的现象是)_____________,怎样判断滴定达到了终点 。
选择恰当的试剂和方法除去下列物质中的少量杂质(括号内为杂质)
(1)C2H6(C2H4)试剂__________,方法________________________________________。
(2)溴苯(溴)试剂__________,方法___________________________________________。
(3)苯(甲苯)试剂________ ,方法____________________________________________。
,方法____________________________________________。
(4)溴化钠(溴)试剂__________,方法_______________________________________。
用系统命名法给下 列物质命名:
列物质命名:
(1) CH3CH(C2H5)CH(CH3)2______________________
(2)  ______________________
______________________
(3)  _____________________
_____________________
(4)2,3-二甲基-4-乙基已烷 ______________________(用结构简式填空)
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应
条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答;[来来]
(1)A是__________、B是________(请填化学式)。
(2)反应①的化学方程式为:_________________ ________
________ _______。
_______。
(3)反应③的离子方程式为:________________________________。
(4)反应④的化学方程式为:________________________________。
某无色溶液可能含有下列钠盐中的几种:
| A.氯化钠 | B.硫化钠 | C.亚硫酸钠 | D.硫代硫酸钠 (E)硫酸钠 (F)碳酸钠.向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生.此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。(已知:硫代硫酸钠的化学式为Na2S2O3, 硫代硫酸钠与稀硫酸的反应式为: |
Na2S2O3+H2SO4="==" Na2SO4+SO2↑+S↓+H2O)
根据上述实验现象回答下列问题
(1)不能使品红试液褪色,说明该气体中不含____________(填分子式).
(2)此无色溶液中至少可能存在哪几种钠盐?请写出全部可能的情况(填写相应的字母).
第一种情况是____________,第二种情况是____________,第三种情况是____________,第四种情况是____________.
(可不填满,也可补充)
(9分)下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,A是红棕色粉末,G是气体,J是黑色晶体。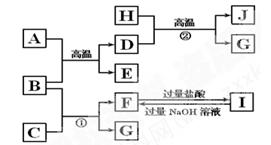
根据图示回答问题:
(1)写出下列物质的化学式:A ,E,I;
(2)反应②的化学方程式是;
(3)J与盐酸反应的化学方程式是;
产生等物质的量G分别消耗单质D与B 的物质的量之比