能正确表示下列反应的离子方程式是
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B.等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ |
| C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O ="HClO+" HSO3- |
| D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: |
2Al3++3SO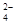 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
铅蓄电池的工作原理为Pb+PbO2+2H2SO4====2PbSO4+2H2O,研读下图,下列判断不正确的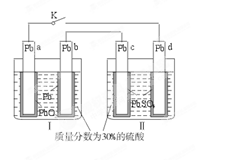
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-====PbO2+4H++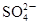 |
| B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
C.K闭合时,Ⅱ中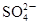 向c电极迁移 向c电极迁移 |
| D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
醋酸溶液中存在电离平衡:CH3COOH H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
| A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
有关如图装置的叙述不正确的是( )
| A.这是电解NaOH溶液的装置 |
| B.该装置中Pt为正极,电极反应为O2+2H2O+4e-=4OH- |
| C.该装置中Fe为负极,电极反应为Fe+2OH-=Fe(OH)2+2e- |
| D.这是一个原电池装置 |
某学生欲完成2HCl+Cu===CuCl2+H2↑反应,设计了如图所示的四个实验,你认为可行的实验是
关于下列装置说法正确的是
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.用装置③精炼铜时,c极为粗铜 |
| C.装置②工作一段时间后,a极附近溶液的pH增大 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |