水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:
3Fe2+ + 2S2O32- + O2 + aOH-=" Y+" S4O62- + 2H2O,下列说法中不正确的是
| A.a=4 |
| B.将Y均匀分散到水中形成的体系具有丁达尔效应 |
| C.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol |
| D.S2O32-是还原剂 |
.在下列有关晶体的叙述中正确的是:
| A.晶体中有阳离子就一定存在阴离子 |
| B.原子晶体中,一定只存在共价键 |
| C.金属晶体的熔点一定比分子晶体高 |
| D.分子晶体中一定存在共价键和分子间作用力 |
具有下列外围电子排布式的基态原子中,最容易形成离子的是:
| A.3s23p1 | B.2s22p2 | C.3s2 | D.4s24p3 |
共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体①Na2O2②SiO2
③石墨④金刚石⑤NaCl⑥白磷中,含有两种作用力的是:
| A.①②③ | B.①③⑥ | C.②④⑥ | D.①②③⑥ |
下列性质符合分子晶体的是:
| A.熔点1070℃,易溶于水,水溶液能导电 |
| B.熔点是10.31℃,液体不导电,水溶液能导电 |
| C.熔点97.81℃,质软,能导电,密度是0.97g/cm3 |
| D.熔点781℃,熔化时能导电,水溶液也能导电 |
.下列说法不正确的是:
| A.若把HF分子写成H2F分子,违反了共价键的饱和性 |
B.若把碳的轨道式写成 则违反了泡里不相容原理 则违反了泡里不相容原理 |
| C.若把Be的基态电子排布式写成1s22s12p1 则违反了能量最低原理 |
D.若把氧的轨道式写成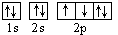 则违反了洪特规则 则违反了洪特规则 |