为达到相应的实验目的,下列实验的设计或操作最合理的是( )
| A.为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值 |
| B.为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。 |
| C.为比较HA和HB两种弱酸的Ka大小,可用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值 |
| D.为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂,用标准盐酸溶液滴定 |
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是
| A.6:5 | B.5:6 | C.11:5 | D.11:6 |
下列离子方程式书写正确的是
| A.氯化铜溶液与铁粉反应:Cu2++Fe = Fe2++Cu |
| B.稀 H2SO4与铁粉反应:2Fe+6H+ = 2Fe3++3H2↑ |
| C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ |
| D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
下列各组离子在给定条件下能大量共存的是()
| A.在pH=1溶液中:NH4+、K+、Al3+、Cl- |
| B.有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- |
| C.有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
| D.在c(H+) =1.0×10-13 mol·L-1的溶液中:Na+、S2-、ClO-、SO32- |
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是
| A.硫酸铜的溶解度 | B.溶液中溶质的质量分数 |
| C.溶液的质量 | D.溶液中Cu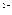 的数目 的数目 |
下列物质的分类结果全部正确的是:()
| A.苯酚——有机物纯碱——盐水——氧化物 |
| B.淀粉——混合物胆矾——纯净物漂白粉——化合物 |
| C.液氯——非电解质碳酸钙——强电解质醋酸——弱电解质 |
| D.金刚石——原子晶体食盐——离子晶体二氧化硅——分子晶体 |