下列反应的离子方程式错误的是
| A.向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH- = CaCO3↓+2H2O+CO32- |
| B.氢氧化钡溶液与硫酸氢钠溶液1:1混合Ba2++ OH-+H+ +SO42- = BaSO4↓+H2O |
| C.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3- ="=" CaCO3↓+H2O |
| D.向溴化亚铁溶液中通入过量氯气:2Fe2+ + 4Br— + 3Cl2 ="=" 2Fe3+ + 2Br2 + 6Cl— |
下列叙述中,不正确的是()
| A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl) |
| B.10 mL 0.10 mol·L―1 CH3COOH溶液加入等物质的量的NaOH后,溶液中有 c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2 |
| D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-) |
1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.4mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为()
| A.2.4 g | B.3.2 g | C.6.4 g | D.9.6 g |
用以下三种途径来制取相等质量的硝酸铜:(1)铜跟浓硝酸反应;(2)铜跟稀硝酸反应;(3)铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。以下叙述中正确的是()
| A.三种途径所消耗的铜的物质的量相等 |
| B.三种途径所消耗的硝酸的物质的量相等 |
| C.所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2) |
| D.所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3) |
下列离子方程式正确的是()
| A.高锰酸钾与浓盐酸反应:2 MnO4- + 10 Cl- + 16 H+ =" 2" Mn2+ + 5 Cl2↑ + 8 H2O |
| B.标准状况112 mLCl2通入10 mL 1mol/LFeBr2溶液:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
C.浓盐酸和KClO3反应: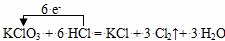 |
| D.硫化钠溶于水显碱性:S2- + 2H2O = H2S + 2OH- |
实验是化学研究的基础,下图中所示的实验方法、装置或操作完全正确的是()