下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO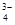 +2I-+2H+
+2I-+2H+ AsO
AsO +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是
| A.甲组操作时,电流计(G)指针发生偏转 |
| B.乙组操作时,C2做正极 |
| C.乙组操作时,C1上发生的电极反应为:I2+2e-===2I- |
| D.甲组操作时,溶液颜色变浅 |
根据下列短周期元素性质的数据判断,下列说法正确的是( )
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(10-10m) 最高或最低化合价 |
0.66 |
1.36 |
1.23 |
1.10 |
0.99 |
1.54 |
0.70 |
1.18 |
| +2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
||
| -2 |
-3 |
-1 |
-3 |
A.元素①⑧形成的化合物具有两性B.元素⑦位于第3周期第ⅤA族
C.元素④⑤形成的化合物是离子化合物 D.元素③的最高价氧化物对应水化物碱性最强
核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中,不正确的是( )
| A.元素X的原子核内质子数为(2a2-1) |
| B.元素X的原子半径一定小于钠的原子半径 |
| C.由元素X形成的某些化合物,可能具有杀菌消毒的作用 |
| D.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数) |
元素周期表中ⅣA元素包括C、Si、Ge、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定。结合所学知识,判断下列反应中(反应条件略)正确的是()
①Pb+2Cl2=PbCl4②Sn+2Cl2=SnCl4 ③SnCl2+Cl2=SnCl4④PbO2+4HCl=PbCl4+2H2O⑤Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O
A.①②④⑤B.①②③④C.①②③D.②③⑤
T °C时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g) XC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
XC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物的投入量 |
3molA、2mol B |
6molA、4molB |
2molC |
| 达到平衡的时间/ min |
5 |
8 |
|
| A的浓度/mol • L-1 |
C1 |
C2 |
|
| C的体积分数/% |
 |
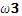 |
|
| 混合气体的密度/g • L-1 |
 |
 |
下列说法正确的是
A.若 x <4,,2C1<C2
B.若 x = 4,则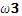 =
=
C.无论x的值是多少贝均有 =
=
D.容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
—种直接肼燃料电池的结构如图所示,下列说法正确的是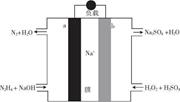
| A.a极为电池的正极 |
| B.电路中每转移6.02X1023个电子,则有1molNa+穿过膜向正极移动 |
C.b极的电极反应式为H202+2e- 20H- 20H- |
| D.用该电池电解饱和食盐水,当阳极生成2.24 L(标准状况)Cl2时,消耗肼0.1 mol |