在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则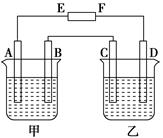
(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为 mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
医生建议患甲状腺肿大的病人多食海带,这是由于海带中含有丰富的;
碘缺乏病是目前已知的导致人类智力障碍的主要原因。为解决这一全国性的问题,我国已经开始实施“智力工程”,最经济的可行措施是。
碘缺乏症遍及全球,多发生于山区。南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有1000万人。为控制该病的发生,较为有效的方法是食用含碘食盐,我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为。氧化产物与还原产物的物质的量之比为。能观察到的明显现象是。
(4)已知KIO3可用电解方法制得。总反应化学方程式为:KI+3H2O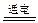 KIO3+3H2↑。在某温度下.若以12 A的电流强度电解KI溶液10 min.理论上可得标况下氢气___________L。
KIO3+3H2↑。在某温度下.若以12 A的电流强度电解KI溶液10 min.理论上可得标况下氢气___________L。
(1)一种变色眼镜的镜片和普通照相感光胶片中含有卤化银。镜片变化是因为卤化银在光的作用下发生化学反应,其反应式是,照相感光胶片曝光的化学反应是
。
(2)在我国干旱严重的华北地区,近年来利用飞机、高炮或火箭等运载工具向过冷支层中播撒碘化银(AgI)或干冰,实现人工增雨(或人工增雪),达到减灾的目的。下列有关人工增雨的评述中,你认为不甚理智的是
| A.它对农业生产条件和大气环境的改善有一定的效益 |
| B.它使用的碘化银中的重金属元素对土壤造成污染 |
| C.它使用的AgI如换成干冰,可避免重金属元素对土壤的污染 |
| D.它是人类彻底战胜自然的表现,体现了人类的力量是无穷的 |
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NH3,请完成下列问题:
(1)Na3N的电子式______________,该化合物是由______________键形成的。
(2)Na3N与水反应方程式为_________________________________________,该反应属______________ (填基本反应类型)反应。
(3)Na3N放入足量盐酸中生成______________种盐,其化学式为______________。
(4)比较Na3N中两种粒子的半径:r(Na+)______________r(N3-)。(填“>”“=”或“<”)
如图:横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-物质的量浓度的对数,回答下列问题。
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为____________。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=____________。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液pH的范围是____________。