在无色强酸性溶液中,下列各组离子能够大量共存的是 ( )
| A.Cl-、Na+、NO3-、Ca2+ | B.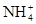 、HCO3-、Cl-、K+ 、HCO3-、Cl-、K+ |
| C.K+、Ba2+、Cl -、SO42- | D.Cu2+、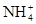 、I-、Cl- 、I-、Cl- |
氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳。若有1%的NaOH转变为 Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂,盐酸浓度的测定结果会( )。
| A.偏低l% | B.偏高1% | C.无影响 | D.偏高0.1% |
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠.按溶液pH由小到大排列正确的是 ( )
| A.④①②⑤⑥③ | B.④①②⑥⑤③ | C.①④②⑥③⑤ | D.①④②③⑥⑤ |
可以充分说明反应 P(g)+Q(g)⇋ R(g)+S(g)在恒温下已达到平衡的是()
| A.反应容器内的压强不随时间改变 |
| B.反应容器内P、Q、R、S四者共存 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |
25℃时,向1 mL pH=1的硫酸中滴加的10 mL pH= b的NaOH溶液,形成的混合溶液成碱性则b可能为()
| A.10 | B.11 | C.12 | D.13 |
在恒温、恒容下,发生如下反应:2A(g)+2B(g) 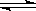 C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是()
C(g)+3D(g),现从两条途径分别建立平衡,途径Ⅰ:A、B的起始浓度均为2 mol·L—1途径Ⅱ: C、D的起始浓度分别为2 mol·L—1 和6 mol·L—1 ,以下叙述正确的是()
A、达到平衡时,途径I的反应速率等于途径Ⅱ的反应速率
B、达到平衡时,途径I所得混合气体的压强等于途径Ⅱ所得混合气体的压强
C、两途径最终达到平衡时,体系内各组分的百分含量相同
D、两途径最终达到平衡时,体系内各组分的百分含量不相同